Atomy i cząsteczki – odkryj, z czego zbudowany jest świat!
Atomy i cząsteczki to najmniejsze składniki materii, z których zbudowane jest wszystko wokół nas – powietrze, woda, przedmioty, a nawet nasze ciała! W tym dziale zajrzymy do mikroświata, aby zrozumieć, czym są elektrony, protony i neutrony , jak powstają wzory chemiczne i co oznaczają symbole pierwiastków. Nauczysz się, jak odczytywać skład cząsteczek i dowiesz się, czym różni się atom od cząsteczki. Gotowy na fascynującą podróż w głąb materii? Zaczynamy!
Atomy i cząsteczki
🌀 Co to jest dyfuzja?
Dyfuzja to takie zjawisko, które zachodzi samo z siebie – bez mieszania czy potrząsania. Polega na tym, że cząstki jednej substancji „rozchodzą się” i mieszają się z cząstkami innej, gdy mają ze sobą kontakt.
🔎 Prosty przykład: Gdy wlejemy sok do wody i nie zamieszamy – po chwili i tak się wymiesza. To właśnie dyfuzja!
📍 Gdzie zachodzi dyfuzja?
w gazach (np. zapach perfum w pokoju),
w cieczach (np. sok i woda),
w substancjach stałych (np. barwnik z kredki wciśniętej w plastelinę).
📘 Definicja szkolna:
Dyfuzja to samorzutne wnikanie cząsteczek jednej substancji między cząstki drugiej, gdy są one w bezpośrednim kontakcie.
⚛️ Co to jest atom?
Atom to najmniejszy „kawałek” z jakiego zbudowany jest cały świat! 🔬 Jest tak malutki, że nie da się go zobaczyć gołym okiem – ale to właśnie z atomów zbudowane są wszystkie rzeczy.
🔧 Z czego składa się atom?
z jądra (w środku, dodatnio naładowane),
z elektronów, które „krążą” wokół jądra i mają ładunek ujemny.
📍 Dodatkowe ciekawostki o atomach:
mają kształt kulisty,
mogą łączyć się w większe grupy – cząsteczki,
atomy tego samego pierwiastka są identyczne.
📘 Definicja szkolna:
Atom to najmniejsza cząstka pierwiastka chemicznego, która zachowuje jego właściwości. Składa się z dodatnio naładowanego jądra i ujemnie naładowanej chmury elektronowej.
🧪 Co to jest pierwiastek chemiczny?
🔍 Prosto mówiąc: To taka substancja, która składa się z jednakowych atomów.
📘 Definicja szkolna:
Pierwiastek chemiczny to zbiór identycznych atomów o tej samej liczbie protonów w jądrze.
🧬 Co to jest związek chemiczny?
🔍 Prosto mówiąc: Gdy różne atomy łączą się trwale ze sobą i tworzą nową substancję – mamy związek chemiczny.
📘 Definicja szkolna:
Związek chemiczny to zbiór takich samych cząsteczek, zbudowanych z różnych, trwale połączonych ze sobą pierwiastków.
Masa atomowa i masa atomu – czy to to samo?
🟢 Masa atomu – co to jest?
To fizyczna masa jednego konkretnego atomu wyrażona w kilogramach (kg) lub gramach.
🔍 Jest bardzo, bardzo mała, np.:
👉 masa jednego atomu węgla ≈ 1,99 × 10⁻²³ g
🔵 Masa atomowa – co to jest?
To liczba bez jednostki, która mówi nam ile razy atom jest cięższy od 1/12 masy atomu węgla-12.
🌍 To taka średnia masa atomu danego pierwiastka, biorąc pod uwagę jego izotopy.
💡 Wyrażamy ją w jednostkach masy atomowej, czyli u.
Przykład:
Masa atomowa wodoru ≈ 1 u
Masa atomowa tlenu ≈ 16 u
🔄 Czy to to samo?
❌ Nie!
Masa atomowa – używamy jej do obliczeń w chemii (w jednostkach u).
Masa atomu – to konkretna liczba w gramach czy kilogramach, bardzo mała, rzadko używana w szkole.
⚖️ W jakich jednostkach podaje się masę atomu?
Atom jest tak malutki, że nie można go ważyć w kilogramach ani gramach. Używa się specjalnej jednostki:
📌 1 u (unit) – to jednostka masy atomowej, używana tylko dla świata atomów.
📘 Definicja szkolna:
Masa atomu wyrażana jest w unitach (u) – jednostkach masy atomowej. 1 u to 1/12 masy atomu węgla.
⚖️ Co to jest masa atomowa? Jeszcze raz
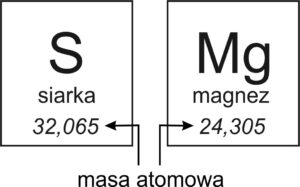
Masa atomowa to waga jednego atomu pierwiastka. Ale ponieważ atomy są tak małe, że nie da się ich zważyć zwykłą wagą, używamy specjalnej jednostki – unit (u).
🧠 Prosto mówiąc: Masa atomowa mówi nam, ile „waży” jeden atom danego pierwiastka – np. atom siarki jest cięższy niż atom wodoru.
📌 Gdzie ją znajdziesz?
Masę atomową każdego pierwiastka odczytujemy z układu okresowego – zwykle to liczba pod symbolem pierwiastka. Zaokrąglamy ją do najbliższej liczby całkowitej.
📘 Definicja szkolna:
Masa atomowa to masa atomu danego pierwiastka chemicznego, wyrażona w jednostkach masy atomowej (u).
📊 Przykłady:
Masa atomowa siarki: mₛ = 32 u
Masa atomowa magnezu: mₘg = 24 u
Atomy i cząsteczki – Masa cząsteczkowa
⚛️ Masa cząsteczkowa – co to takiego?
Masa cząsteczkowa mówi nam, ile waży jedna cząsteczka danego związku chemicznego.
🔍 To tak, jakbyśmy liczyli wagę wszystkich klocków LEGO, z których zbudowana jest cząsteczka.
👩🔬 Jak ją obliczyć?
👉 Dodajemy do siebie masy atomowe wszystkich atomów, które wchodzą w skład cząsteczki.
📘 Definicja szkolna:
Masa cząsteczkowa to masa cząsteczki pierwiastka lub związku chemicznego, wyrażona w jednostkach masy atomowej (u).
🧮 Przykłady krok po kroku
☁️ Cząsteczka tlenu O₂
📌 Masa atomowa tlenu O = 16 u
📌 W cząsteczce są 2 atomy → liczymy:
mO2 = 2 × 16 u = 32 u
💨 Dwutlenek węgla CO₂
📌 Masa atomowa węgla C = 12 u
📌 Masa atomowa tlenu O = 16 u
mCO2 = 12 u + 2 × 16 u = 44 u
🧪 Wodorotlenek glinu Al(OH)₃
📌 Masa atomowa Al = 27 u
📌 Masa atomowa O = 16 u
📌 Masa atomowa H = 1 u
mAl(OH)3 = 27 u + 3 × 16 u + 3 × 1 u = 78 u
⚙️ Siarczyn niklu(II) Ni₂(SO₃)₃
📌 Masa atomowa Ni = 59 u
📌 Masa atomowa S = 32 u
📌 Masa atomowa O = 16 u
mNi₂(SO₃)₃ = 2 × 59 u + 3 × 32 u + 9 × 16 u = 358 u
🎒 ZAPAMIĘTAJ:
Pierwiastki z układu okresowego dają Ci liczby potrzebne do obliczeń.
Masa cząsteczkowa to suma wszystkich atomów w cząsteczce.
Używamy jednostki u (unit).
Atomy i cząsteczki – atom pierwiastka
🧠 Z czego składa się atom?
Wyobraź sobie, że atom to taki mikroskopijny układ słoneczny. W jego centrum – jak słońce – znajduje się jądro, a wokół krążą elektrony, jak planety 🌍☄️.
Jądro to centrum dowodzenia całego atomu – jest bardzo małe, ale bardzo ważne. Znajdują się w nim:
protony – mają ładunek dodatni (➕),
neutrony – nie mają żadnego ładunku (są obojętne 😶).
Wokół jądra krążą elektrony – mają ładunek ujemny (➖). Krążą po tzw. powłokach elektronowych (możesz je sobie wyobrazić jak orbitujące pierścienie).
🔬 Ciekawostka: Wszystko, co Cię otacza, zbudowane jest z atomów – także Ty! 😊
📘 Szkolna definicja – Z czego zbudowany jest atom pierwiastka?
Atom pierwiastka chemicznego składa się z:
jądra atomowego (znajdują się w nim protony i neutrony),
oraz z powłok elektronowych, na których krążą elektrony.
Składniki atomu:
| Składnik | Ładunek elektryczny | Gdzie się znajduje? | Masa (przybliżona) |
|---|---|---|---|
| Proton (p⁺) | dodatni (+) | w jądrze | ok. 1 u |
| Neutron (n⁰) | obojętny (0) | w jądrze | ok. 1 u |
| Elektron (e⁻) | ujemny (−) | na powłokach | ok. 0 u (zaniedbywalna) |
🧪 Dodatkowe pojęcia
🔹 Nukleony – to wspólna nazwa dla protonów i neutronów, czyli wszystkich cząstek znajdujących się w jądrze atomowym.
🔹 Izotopy – to odmiany tego samego pierwiastka chemicznego, które mają różną liczbę neutronów w jądrze, ale taką samą liczbę protonów.
POWŁOKI ELEKTRONOWE

🧲 CZYM SĄ POWŁOKI ELEKTRONOWE?
Wyobraź sobie, że atom to miniaturowa planeta z pierścieniami 🌍🪐.
W środku znajduje się jądro atomu – to taki „rdzeń planety”, a wokół niego krążą elektrony. Ale nie wszędzie! Elektrony krążą po określonych torach, które nazywamy powłokami elektronowymi.
📏 Każda powłoka znajduje się coraz dalej od jądra i ma swoją nazwę:
Najbliżej jądra jest powłoka K,
potem L, M, N, O, P, aż do Q.
🔋 Elektrony walencyjne to te elektrony, które znajdują się najdalej od jądra – na ostatniej powłoce.
To one biorą udział w reakcjach chemicznych i łączą się z innymi atomami.
📘 Wersja szkolna – definicje i szczegóły
Powłoki elektronowe to przestrzenie wokół jądra atomowego, po których poruszają się elektrony. Każda powłoka ma określoną maksymalną liczbę elektronów, które może pomieścić.
Kolejność oznaczeń powłok: K → L → M → N → O → P → Q (od najbliższej jądra do najbardziej oddalonej)
📊 Maksymalna liczba elektronów na powłoce:
| Powłoka | Liczba elektronów |
|---|---|
| K | 2 |
| L | 8 |
| M | 18 |
| N | 32 |
| … | … |
🧪 Czym są elektrony walencyjne?
Elektrony walencyjne – to elektrony znajdujące się na ostatniej (najbardziej zewnętrznej) powłoce elektronowej. To one decydują o właściwościach chemicznych pierwiastka i o tym, z jakimi innymi pierwiastkami może się łączyć.
❓Jak rozpoznać, ile jest powłok i elektronów walencyjnych?
Dla pierwiastków grup głównych (czyli grup: 1, 2, 13–18 w układzie okresowym):
Numer okresu = liczba powłok elektronowych (np. okres 2 → 2 powłoki: K i L),
Numer grupy = liczba elektronów walencyjnych (np. grupa 16 → 6 elektronów walencyjnych).
📌 Powtórka skrótem:
Powłoka elektronowa – „orbita” elektronu wokół jądra.
Powłoka walencyjna – ostatnia, najbardziej oddalona od jądra.
Elektrony walencyjne – te elektrony, które są na ostatniej powłoce.
Decydują o reakcjach chemicznych i tworzeniu wiązań 🧪.
ustalanie liczby protonów i elektronów
🔎 Jak ustalić liczbę protonów i elektronów w atomie pierwiastka?
👧 Wersja dla ucznia – prosto i obrazowo
Każdy atom ma środek, czyli jądro, w którym siedzą protony – cząsteczki z ładunkiem dodatnim ➕.
Wokół jądra krążą elektrony – z ładunkiem ujemnym ➖.
🔁 W atomie liczba protonów jest zawsze równa liczbie elektronów. Dzięki temu atom jest elektrycznie obojętny (czyli nie ma przewagi ani plusów, ani minusów).
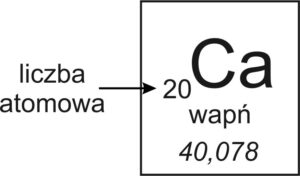
📍 Aby dowiedzieć się, ile atom ma protonów i elektronów, wystarczy sprawdzić liczbę atomową tego pierwiastka w układzie okresowym!
🧪 Przykład:
Liczba atomowa wapnia = 20
✅ Liczba protonów (p⁺) w wapniu = 20
✅ Liczba elektronów (e⁻) w wapniu = 20
📘 Wersja szkolna – definicja
Liczba atomowa pierwiastka (Z) to liczba protonów (p⁺) w jądrze atomowym.
W przypadku atomu elektrycznie obojętnego, liczba protonów (p⁺) jest równa liczbie elektronów (e⁻).
Z = p⁺ = e⁻
Dzięki tej zasadzie łatwo można określić, ile cząstek znajduje się w atomie konkretnego pierwiastka 💡
💡 Jak obliczyć liczbę elektronów na danej powłoce?
Wokół jądra atomu znajdują się powłoki elektronowe. Możesz je wyobrazić sobie jak krążki lub pierścienie, na których „krążą” elektrony.
🧠 Każda powłoka ma swoją nazwę (K, L, M, N…) i może pomieścić tylko określoną liczbę elektronów. Aby to obliczyć, używamy bardzo prostego wzoru:
👉 2n²
Gdzie:
nto numer powłoki (np. K = 1, L = 2 itd.),2n²mówi nam, ile maksymalnie elektronów zmieści się na tej powłoce.
📘 Szkolna wersja z przykładami
| Nazwa powłoki | Numer powłoki (n) | Obliczenie 2n² | Maksymalna liczba elektronów |
|---|---|---|---|
| K | 1 | 2 × 1² = 2 | 2 |
| L | 2 | 2 × 2² = 8 | 8 |
| M | 3 | 2 × 3² = 18 | 18 |
| N | 4 | 2 × 4² = 32 | 32 |
🧪 Jak obliczyć liczbę elektronów na powłokach elektronowych?
Aby poznać, ile elektronów znajduje się na każdej powłoce danego pierwiastka, musimy znać:
liczbę atomową (czyli ile łącznie jest elektronów w atomie),
okres – mówi, ile powłok elektronowych ma atom,
grupę główną – wskazuje, ile elektronów walencyjnych znajduje się na ostatniej powłoce.
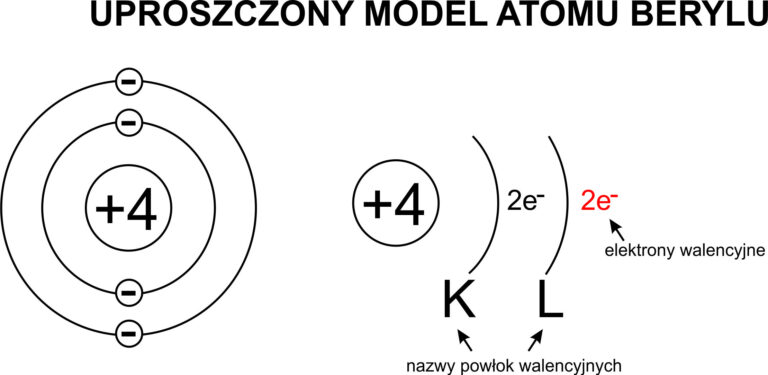
🔹 Przykład 1: Beryl (Be)
📘 Liczba atomowa: 4
📘 Okres: 2 → czyli 2 powłoki: K i L
📘 Grupa główna: 2 → na ostatniej powłoce (L) są 2 elektrony walencyjne
👉 Rozkład elektronów:
K – 2 elektrony
L – 2 elektrony
📌 Zapis: K2 L2
➡️ Suma elektronów = 2 + 2 = 4 ✅ – zgadza się z liczbą atomową!
🔹 Przykład 2: German (Ge)
📘 Liczba atomowa: 32
📘 Okres: 4 → czyli 4 powłoki: K, L, M, N
📘 Grupa główna: 14 (czyli 4. grupa główna) → 4 elektrony walencyjne na powłoce N
Krok po kroku:
K → zawsze 2 elektrony
L → zgodnie ze wzorem
2n²= 8 elektronówN → 4 elektrony (z grupy głównej)
M → liczymy ile zostało:
👉 32 (łącznie) – (2 + 8 + 4) = 18 elektronów na powłoce M
📌 Zapis powłokowy: K2 L8 M18 N4
🧠 Jak to zapamiętać?
✅ Na pierwszej powłoce zawsze są maks. 2 elektrony
✅ Na ostatniej – ilość elektronów z grupy głównej
✅ Pozostałe elektrony rozkładamy na powłoki zgodnie ze wzorem 2n², a ostatnią niewypełnioną wyliczamy matematycznie.
Inny sposób na zrozumienie tematu
Jak obliczyć liczbę elektronów na powłokach elektronowych
na przykładzie Berylu?
- Beryl ma liczbę atomową 4 (czyli suma wszystkich elektronów na powłokach tego pierwiastka musi tyle wynosić)
- Jest w drugim okresie układu okresowego pierwiastków, czyli ma 2 powłoki elektronowe „K” i „L”.
- Pierwsza powłoka ma 2 elektrony walencyjne (zawsze)
- Druga powłoka również ma 2 elektrony walencyjne dlatego, że suma wszystkich elektronów we wszystkich powłokach danego pierwiastka musi się równać sumie liczby atomowej tego pierwiastka.
Czyli: K2L2
Jak obliczyć liczbę elektronów na powłokach elektronowych na przykładzie pierwiastka, który ma cztery powłoki?
🧪 Przykład: Obliczanie liczby elektronów walencyjnych pierwiastka German (symbol „Ge”)
Liczba atomowa Ge to 32 – oznacza to, że łącznie we wszystkich powłokach atomu znajduje się 32 elektrony.
➡️ „Ge” leży w 4 okresie układu okresowego pierwiastków, czyli ma 4 powłoki: K, L, M, N.
➡️ Powłoka, na której leży to powłoka N.
➡️ German leży w 4 grupie głównej, więc na ostatniej powłoce (N) ma 4 elektrony walencyjne.
Wiemy już:
K2 (zawsze na pierwszej powłoce są 2 elektrony),
N4 (z grupy głównej),
L ma 8 elektronów (wynika ze wzoru 2n², n=2 → 2×2² = 8).
Znamy więc:
K2 L8 N4
Potrzebujemy jeszcze uzupełnić powłokę M.
Suma elektronów, które już znamy:
2 (K) + 8 (L) + 4 (N) = 14
A więc:
32 (liczba atomowa Ge) – 14 = 18
➡️ Powłoka M ma 18 elektronów
✅ Zapis powłok i elektronów pierwiastka German (Ge):
K2 L8 M18 N4
🧮 Jak obliczyć liczbę elektronów na powłokach elektronowych na przykładzie pierwiastka, który ma więcej powłok?
Obliczamy analogicznie, czyli:
Na pierwszej powłoce jest tyle elektronów, ile wychodzi ze wzoru (2n²),
Na drugiej powłoce – również według wzoru,
Na kolejnej powłoce – tak samo.
➡️ Na ostatniej powłoce jest tyle elektronów, ile wynika z grupy układu okresowego.
➡️ Przedostatnią powłokę wylicza się w ten sposób:
Patrzymy na masę atomową danego pierwiastka,
Zliczamy, ile elektronów jest już rozpisanych na wszystkich innych powłokach,
Następnie odejmujemy tę sumę od liczby atomowej, aby uzyskać liczbę elektronów na przedostatniej powłoce.
Atomy i cząsteczki
Przykładowe zestawienia zadań
Przykładowe zestawienia zadań, które mogą być idealnym treningiem przed realnym sprawdzianem.
Pliki do pobrania w .pdf i wydrukowania TUTAJ
