Sole – poznaj związki, które znajdziesz wszędzie!
Witamy w dziale „Sole”, gdzie krok po kroku odkryjesz, czym są sole i jak powstają. To jedne z najczęściej spotykanych związków chemicznych – znajdują się w kuchni, w skałach, a nawet w naszym organizmie! W prosty i zrozumiały sposób wyjaśnimy, jak rozpoznać sole, jak powstają podczas reakcji chemicznych i jakie mają zastosowanie. Zobaczysz też, jak łatwo zrozumieć ich wzory i nazwy. Gotowy na kolejną porcję chemicznej wiedzy? Zaczynamy!
Sole
🧂 Czym są sole?
👉 Sole to związki chemiczne, które zbudowane są z:
kationów metali (np. sodu Na⁺, potasu K⁺) lub kationów amonu (NH₄⁺),
oraz anionów reszt kwasowych (np. Cl⁻, SO₄²⁻).
📚 Definicja szkolna: Sole to związki chemiczne zawierające kationy metali (lub kationy amonu) oraz aniony reszt kwasowych.
💧 Co to jest dysocjacja jonowa?
👉 To proces, w którym sól rozpuszcza się w wodzie i rozpada się na jony – czyli:
kationy metali (lub amonu),
oraz aniony reszt kwasowych.
📚 Definicja szkolna: Dysocjacja jonowa to rozpad soli na jony pod wpływem cząsteczek wody. Zachodzi także w stanie stopionym.
⚖️ Co to jest reakcja zobojętnienia?
👉 To reakcja kwasu z zasadą, w której jon H⁺ łączy się z jonem OH⁻, tworząc cząsteczkę wody.
📚 Definicja szkolna: Reakcja między kationami wodoru H⁺ a anionami wodorotlenkowymi OH⁻, której produktem jest woda.
✨ Metale szlachetne – co to znaczy?
👉 Są to metale bardzo odporne chemicznie, np. złoto, platyna, srebro.
Nie reagują z kwasami tak łatwo jak inne metale – nie wypierają wodoru z roztworów kwasów ani z wody.
📚 Definicja szkolna: Metale mniej aktywne chemicznie od wodoru.
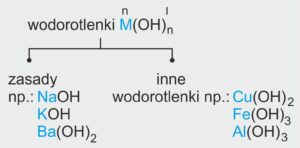
🧱 Tlenek zasadowy – co to takiego?
👉 To tlenek metalu, który:
reaguje z kwasami tworząc sól i wodę,
często reaguje z wodą, tworząc zasadę (np. Na₂O + H₂O → NaOH).
📚 Definicja szkolna: Tlenek metalu, który reaguje z kwasem tworząc sól.
🌫 Tlenek kwasowy – i co dalej?
👉 To najczęściej tlenek niemetalu, który:
reaguje z zasadami tworząc sól i wodę,
może reagować z wodą, tworząc kwas.
📚 Definicja szkolna: Tlenek, najczęściej niemetalu, który reaguje z zasadą tworząc sól.
🔥 Zjawisko endotermiczne – brzmi poważnie, ale...
👉 To po prostu takie zjawisko, które pobiera ciepło z otoczenia – np. gdy lód topnieje, zabiera ciepło z dłoni i robi się zimno! 🧊
📚 Definicja szkolna: Zjawisko fizyczne przebiegające z pobieraniem ciepła z otoczenia.
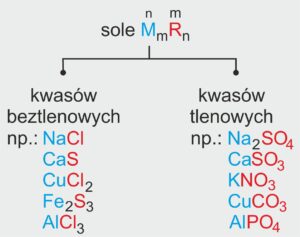
🧂 Jak są zbudowane sole?
👉 Sole to związki chemiczne, które powstają z połączenia dwóch składników:
kationu metalu (np. sodu Na⁺, wapnia Ca²⁺) albo kationu amonu (NH₄⁺),
oraz anionu reszty kwasowej (np. Cl⁻ z kwasu solnego, SO₄²⁻ z kwasu siarkowego).
📘 Dla lepszego zrozumienia:
Można powiedzieć, że sól to jak dziecko dwóch rodziców – jednego „z kwasu” i drugiego „z zasady” (czyli wodorotlenku). Gdy połączą się ze sobą – powstaje sól!
📚 Definicja szkolna:
Sole to związki chemiczne zbudowane z kationów metalu (lub kationów amonu) i anionów reszty kwasowej. Są to związki pochodzące od wodorotlenków i kwasów.
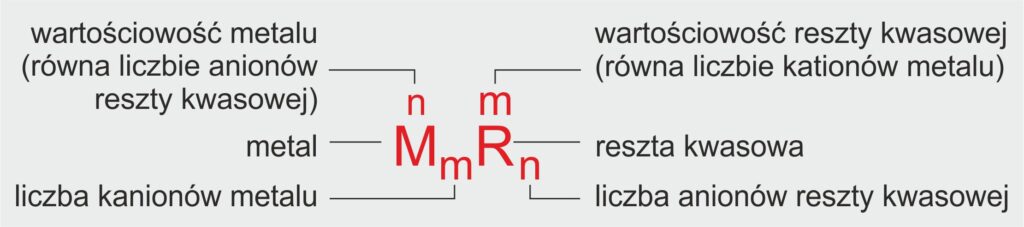
🔬 Wzór ogólny soli
MmRn
gdzie:
M – symbol metalu (np. Na, Ca, K) lub jon amonowy NH₄⁺
R – symbol reszty kwasowej (np. Cl, SO₄, NO₃)
m – liczba atomów metalu (lub jonów amonowych)
n – liczba reszt kwasowych
👉 Indeksy m i n dobiera się tak, aby ładunki kationów i anionów wzajemnie się równoważyły (suma ładunków dodatnich = suma ładunków ujemnych).
🧪 Jak tworzy się nazwy soli?
Nazwę soli tworzy się na podstawie nazwy kwasu, od którego pochodzi, oraz metalu (lub kationu amonu), który ją tworzy.
👉 Jeśli metal przyjmuje różne wartościowości, należy je zaznaczyć w nawiasie rzymskim po jego nazwie.
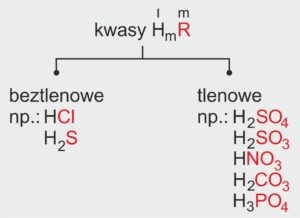
✅ Nazwy soli kwasów beztlenowych mają końcówkę -ek.
✅ Nazwy soli kwasów tlenowych mają końcówkę -an.
📊 Tabela: Rodzaje kwasów i nazwy soli
| Rodzaje kwasów | Nazwa kwasu | Nazwa soli | Wartościowość reszty kwasowej |
|---|---|---|---|
| kwasy beztlenowe | chlorowodorowy | chlorek | I |
| kwasy beztlenowe | siarkowodorowy | siarczek | II |
| kwasy tlenowe | siarkowy(VI) | siarczan(VI) | II |
| kwasy tlenowe | siarkowy(IV) | siarczan(IV) | II |
| kwasy tlenowe | azotowy(V) | azotan(V) | I |
| kwasy tlenowe | węglowy | węglan | II |
| kwasy tlenowe | fosforowy(V) | fosforan(V) | III |
🧩 Jak ustalić wzór soli?
Dla ucznia – w prosty sposób:
Aby zapisać wzór soli, trzeba połączyć:
kation metalu (np. Na⁺, Ca²⁺) lub kation amonu (NH₄⁺),
z anionem reszty kwasowej (np. Cl⁻, SO₄²⁻, NO₃⁻).
🧠 Zasada: Łączymy je tak, żeby suma ładunków dodatnich i ujemnych wynosiła zero – czyli zrównoważenie ładunków! ⚖️
📘 Szkolna definicja:
Wzór sumaryczny soli można ustalić na podstawie wzoru ogólnego:
Mⁿ⁺ + Rᵐ⁻ → MₘRₙ
Gdzie:
Mⁿ⁺ – kation metalu o ładunku dodatnim,
Rᵐ⁻ – anion reszty kwasowej o ładunku ujemnym,
MₘRₙ – sól, w której indeksy dolne dopasowujemy tak, aby ładunki się znosiły.
📌 Przykład:
Kwas: H₂SO₄ – kwas siarkowy(VI)
Reszta kwasowa: SO₄²⁻
Metal: Na⁺ (sód)
Chcemy połączyć Na⁺ z SO₄²⁻ → musimy użyć 2 atomów sodu, żeby zrównoważyć ładunek 2⁻ reszty kwasowej.
✅ Wzór soli: Na₂SO₄
➡️ Sól: siarczan(VI) sodu
wzór ogólny

📘 Jak ustalić wzór sumaryczny soli?
Aby ustalić wzór sumaryczny soli, należy zastosować regułę krzyżową:
Liczba atomów metalu (M) × wartościowość reszty kwasowej (R) = Liczba atomów reszty kwasowej (R) × wartościowość metalu (M)
Czyli:
m × n⁺ = n × m⁻
✅ Dzięki tej regule otrzymujemy zrównoważony związek chemiczny, w którym suma ładunków dodatnich i ujemnych jest równa zero.
📘 Przykłady nazw i wzorów soli
| Rodzaj kwasu | Nazwa kwasu | Reszta kwasowa | Wzór soli | Nazwa soli |
|---|---|---|---|---|
| Beztlenowy | kwas chlorowodorowy | Cl⁻ | NaCl | chlorek sodu |
| Beztlenowy | kwas siarkowodorowy | S²⁻ | FeS | siarczek żelaza(II) |
| Tlenowy | kwas siarkowy(VI) | SO₄²⁻ | Na₂SO₄ | siarczan(VI) sodu |
| Tlenowy | kwas azotowy(V) | NO₃⁻ | KNO₃ | azotan(V) potasu |
| Tlenowy | kwas fosforowy(V) | PO₄³⁻ | Ca₃(PO₄)₂ | fosforan(V) wapnia |
GDZIE STOSUJE SIĘ SOLE?
| Rodzaj soli | Zastosowanie |
|---|---|
| Chlorki | – solenie i konserwowanie potraw; – medycyna; – farmacja; – mikrobiologia; – do posypywania oblodzonych nawierzchni; – srebrzenie; – fotografika. |
| Azotany(V) | – rolnictwo (nawozy sztuczne); – konserwowanie potraw; – wyrób leków i barwników; – produkcja luster i farb; – pirotechnika. |
| Węglany | – produkcja środków myjących, piorących i kosmetyków; – produkcja szkła i papieru; – rolnictwo (nawozy sztuczne); – budownictwo; – produkcja kredy szkolnej. |
| Siarczany(VI) | – produkcja szkła; – rolnictwo (nawozy sztuczne); – medycyna (gips); – produkcja H₂SO₄; – budownictwo. |
| Fosforany(V) | – rolnictwo (nawozy sztuczne); – otrzymywanie fosforu; – przemysł spożywczy (dodatek do żywności). |
🧪 Wodorosole i hydroksosole – co to takiego?
👉 Wodorosole (inaczej: sole kwaśne)
To sole kwasów wieloprotonowych, w których w anionie reszty kwasowej nadal obecny jest atom wodoru.
Wodorosole powstają, gdy nie wszystkie atomy wodoru w cząsteczce kwasu zostaną zastąpione przez kation metalu.
📌 Przykłady wodorosoli:
NaHCO₃ – wodorowęglan sodu (znany jako soda oczyszczona) – stosowany jako środek spulchniający i pianotwórczy (np. w kuchni).
NaHSO₄ – wodorosiarczan sodu – używany do obniżania pH w wodach (np. w oczkach wodnych, basenach).
👉 Hydroksosole
To sole, które w swojej budowie zawierają kation metalu lub amonu, anion reszty kwasowej oraz dodatkowo anion wodorotlenkowy (OH⁻).
Są to zatem związki, które zachowują właściwości zarówno soli, jak i zasad.
📌 Przykłady hydroksosoli:
CaCl(OH) – chlorek wodorotlenek wapnia
MgBr(OH) – bromek wodorotlenek magnezu
🧪 Wodorosole i hydroksosole – co to takiego?
👉 Wodorosole (inaczej: sole kwaśne)
To sole kwasów wieloprotonowych, w których w anionie reszty kwasowej nadal obecny jest atom wodoru.
Wodorosole powstają, gdy nie wszystkie atomy wodoru w cząsteczce kwasu zostaną zastąpione przez kation metalu.
📌 Przykłady wodorosoli:
NaHCO₃ – wodorowęglan sodu (znany jako soda oczyszczona) – stosowany jako środek spulchniający i pianotwórczy (np. w kuchni).
NaHSO₄ – wodorosiarczan sodu – używany do obniżania pH w wodach (np. w oczkach wodnych, basenach).
👉 Hydroksosole
To sole, które w swojej budowie zawierają kation metalu lub amonu, anion reszty kwasowej oraz dodatkowo anion wodorotlenkowy (OH⁻).
Są to zatem związki, które zachowują właściwości zarówno soli, jak i zasad.
📌 Przykłady hydroksosoli:
CaCl(OH) – chlorek wodorotlenek wapnia
MgBr(OH) – bromek wodorotlenek magnezu
⚡ Na czym polega dysocjacja jonowa soli?
Dysocjacja jonowa to rozpad soli na jony pod wpływem wody 💧. Gdy sól rozpuści się w wodzie, jej cząsteczki ulegają rozpadowi na kationy (dodatnie jony metalu lub amonu) i aniony (ujemne jony reszty kwasowej).
👉 Dzięki obecności tych jonów, roztwory soli przewodzą prąd elektryczny – są więc elektrolitami ⚡.
🧪 Jak to działa na przykładzie soli kuchennej?
Kiedy NaCl (chlorek sodu) trafia do wody:
cząsteczki wody otaczają kryształ NaCl,
osłabiają wiązania w cząsteczce soli,
odrywają kationy Na⁺ i aniony Cl⁻,
jony zostają swobodnie zawieszone w wodzie, a kryształ całkowicie się rozpada.
📌 W skrócie:
NaCl → Na⁺ + Cl⁻
🔍 Jakie jony powstają podczas dysocjacji soli?
Kationy metali (np. Na⁺, Ca²⁺, Al³⁺) lub kation amonu NH₄⁺
Aniony reszt kwasowych (np. Cl⁻, SO₄²⁻, NO₃⁻)
📌 Ważne!
Ładunek kationu = wartościowość metalu
Ładunek anionu = wartościowość reszty kwasowej
Suma ładunków dodatnich = suma ładunków ujemnych ⚖️
Dzięki temu równowaga ładunków zostaje zachowana, a roztwór staje się zdolny do przewodzenia prądu. To właśnie dzięki dysocjacji możemy m.in. wykrywać obecność soli w wodzie lub korzystać z niej w laboratoriach chemicznych! 🧫
💧 Czy sole dobrze rozpuszczają się w wodzie?
To zależy od rodzaju soli! Nie wszystkie sole rozpuszczają się równie dobrze w wodzie. 🌊
🧪 Prosto mówiąc:
Niektóre sole są jak cukier – znikają w wodzie bardzo szybko. Inne natomiast zachowują się jak piasek – trudno je rozpuścić.
🔹 Sole dobrze rozpuszczalne w wodzie
✅ Rozpuszczają się łatwo – tworząc przejrzyste roztwory.
wszystkie azotany(V) (np. NaNO₃, KNO₃)
sole sodu (Na⁺)
sole potasu (K⁺)
sole amonu (NH₄⁺)
🔸 Sole trudno rozpuszczalne lub prawie nierozpuszczalne
❌ Rozpuszczają się słabo – mogą osadzać się na dnie naczynia.
wszystkie fosforany (z wyjątkiem fosforanu sodu i wapnia)
sole wapnia (np. CaCO₃)
sole magnezu (np. MgCO₃)
chlorek ołowiu(II) – PbCl₂
jodek ołowiu(II) – PbI₂
📌 Zapamiętaj: To, czy sól rozpuści się w wodzie, zależy od jej składu chemicznego. W laboratoriach często korzysta się z tabel rozpuszczalności, by to sprawdzić! 📊
🧂 W jakim stanie skupienia występują sole?
Sole najczęściej kojarzą się z białym proszkiem – i słusznie! Ale nie wszystkie sole wyglądają tak samo i mają taką samą postać.
🧪 Zrozum to prosto:
Sole mogą występować w różnych stanach skupienia – to zależy od ich rodzaju i warunków, np. temperatury.
📋 Stany skupienia soli
🔹 Stały stan skupienia – większość soli, np. chlorek sodu (NaCl), to substancje stałe o budowie krystalicznej.
🔸 Ciekły stan skupienia (w temperaturze pokojowej) – niektóre sole, np. fluorek antymonu(V) – SbF₅, są cieczami.
🔹 Substancja stała, ale bez budowy krystalicznej – np. difosforan(V) cyny(II) – Sn₂P₂O₇. Mimo że jest w stanie stałym, nie tworzy uporządkowanej struktury (czyli kryształów).
📌 Podsumowanie szkolne:
Sole występują zazwyczaj w stałym stanie skupienia, ale niektóre mogą być cieczami lub ciałami stałymi bez struktury krystalicznej.
⚗️ Na czym polega reakcja zobojętniania?
🔍 Zrozum to prosto:
Wyobraź sobie, że kwas i zasada to dwie przeciwności – jak ogień i woda. Kiedy się spotkają, neutralizują się nawzajem i powstaje coś zupełnie spokojnego – czyli woda 💧. To właśnie jest reakcja zobojętniania.
🧪 Co się dzieje w reakcji zobojętniania?
Kwas dostarcza jony H⁺ (kationy wodoru),
Zasada dostarcza jony OH⁻ (aniony wodorotlenkowe),
H⁺ + OH⁻ → H₂O (cząsteczka wody)
Powstaje woda, która ma odczyn obojętny – czyli nie jest ani kwasem, ani zasadą.
📘 Wersja szkolna:
Reakcja zobojętniania to reakcja chemiczna zachodząca między kwasem a zasadą, w wyniku której powstaje cząsteczka wody, a odczyn roztworu staje się obojętny.
⚗️ Jak przebiega reakcja zobojętniania?
🔍 Wyjaśnienie dla ucznia:
Reakcja zobojętniania to spotkanie kwasu i zasady, które neutralizują się nawzajem. Gdy wszystko jest w idealnych proporcjach – powstaje sól i woda, a roztwór nie jest już ani kwaśny, ani zasadowy, tylko obojętny 🟰.
🔬 Przebieg reakcji:
✅ Kwas – dostarcza jony H⁺, czyli ma odczyn kwaśny
➕
✅ Zasada – dostarcza jony OH⁻, czyli ma odczyn zasadowy
⬇
➡ H⁺ + OH⁻ → H₂O (woda)
➡ Powstaje też sól 🧂
📘 Wersja szkolna:
Reakcja zobojętniania (inaczej: neutralizacji) to reakcja chemiczna zachodząca pomiędzy kwasem a zasadą, której produktami są sól i woda.
Odczyn roztworu po reakcji staje się obojętny, jeśli ilości reagentów zostały odpowiednio dobrane.
🔩 Co to jest szereg aktywności metali?
🧠 Wyjaśnienie dla ucznia:
Szereg aktywności metali to lista metali ułożona od najmniej do najbardziej aktywnych. Pokazuje, jak chętnie dany metal wchodzi w reakcje chemiczne – zwłaszcza z kwasami lub wodą 💥
Im wyżej znajduje się metal w szeregu, tym łatwiej reaguje – może nawet wypierać wodór z kwasu lub z wody!
📘 Wersja szkolna:
Szereg aktywności metali to zbiór metali uporządkowanych według wzrastającej aktywności chemicznej.
Aktywność chemiczną metali określa się na podstawie zdolności wypierania wodoru z kwasów i wody.
🧪 Pamiętaj!
✅ Metale bardziej aktywne od wodoru – wypierają go z wody i z roztworów kwasów.
❌ Metale mniej aktywne od wodoru – nie są w stanie wypierać wodoru.
🧪 wzrost aktywności chemicznej metali – wodór jako granica

🧪 wzrost aktywności chemicznej metali – zestawienie w tabeli
| Metale bardziej aktywne od wodoru | Wodór (H) | Metale mniej aktywne od wodoru | ||
|---|---|---|---|---|
| Lit (Li) | Potas (K) | H | Miedź (Cu) | Srebro (Ag) |
| Wapń (Ca) | Sód (Na) | Rtęć (Hg) | Złoto (Au) | |
| Magnez (Mg) | Cynk (Zn) | Platyna (Pt) | — | |
📌 Legenda:
👉 Metale po lewej stronie wypierają wodór z kwasów – są bardziej aktywne.
👉 Metale po prawej stronie są mniej aktywne – nie wypierają wodoru z kwasów.
🔩 Szereg aktywności metali – przykładowe metale
| Pozycja w szeregu | Metal | Czy wypiera wodór z kwasu? |
|---|---|---|
| 1 | Lit (Li) | ✅ Tak |
| 2 | Potas (K) | ✅ Tak |
| 3 | Wapń (Ca) | ✅ Tak |
| 4 | Sód (Na) | ✅ Tak |
| 5 | Magnez (Mg) | ✅ Tak |
| 6 | Cynk (Zn) | ✅ Tak |
| 7 | Żelazo (Fe) | ✅ Tak |
| 8 | Wodór (H) | — punkt odniesienia |
| 9 | Miedź (Cu) | ❌ Nie |
| 10 | Srebro (Ag) | ❌ Nie |
| 11 | Złoto (Au) | ❌ Nie |
🧪 Czy można otrzymać sól z metalu i kwasu?
✅ Tak! Reakcja kwasu z metalem bardziej aktywnym od wodoru to jeden ze sposobów otrzymywania soli.
Ogólny zapis przebiegu reakcji otrzymywania soli z metalu i kwasu:
METAL + KWAS → SÓL + H2↑
📌 Strzałka w górę (↑) oznacza, że w trakcie reakcji wydziela się gazowy wodór.
🧠 Ważne: W reakcji bierze udział tylko taki metal, który w szeregu aktywności znajduje się przed wodorem – czyli jest od niego bardziej aktywny.
🧪 Czy można otrzymać sól z tlenku metalu i kwasu?
✅ Tak! Reakcja tlenku metalu (czyli tlenku zasadowego) z kwasem to kolejny sposób otrzymywania soli.
Ogólny zapis reakcji:
TLENEK METALU + KWAS → SÓL + WODA
💡 Pamiętaj: Reakcja zachodzi, gdy tlenek metalu ma właściwości zasadowe i reaguje z kwasem, tworząc sól i wodę – czyli typowa reakcja zobojętniania!
⚗️ Jak ogólnie zapisać przebieg reakcji wodorotlenku metalu
z tlenkiem niemetalu?
✅ Reakcja wodorotlenku metalu (czyli zasady) z tlenkiem niemetalu (czyli tlenkiem kwasowym) prowadzi do powstania soli i wody.
Ogólny zapis reakcji:
WODOROTLENEK + TLENEK NIEMETALU ➡️ SÓL + WODA
💡 Zapamiętaj: To przykład reakcji zobojętniania – zasada i tlenek kwasowy tworzą neutralną sól oraz wodę.
⚗️ Jak zapisać wzory substancji trudno rozpuszczalnych w wodzie?
🧪 Substancje trudno rozpuszczalne w wodzie, takie jak AgCl (chlorek srebra(I)), zapisuje się cząsteczkowo, ponieważ nie ulegają dysocjacji jonowej – nie rozpuszczają się w wodzie.
Przykład reakcji:
AgNO₃ (azotan(V) srebra(I)) + HCl (kwas chlorowodorowy) → AgCl ↓ (chlorek srebra(I)) + HNO₃ (kwas azotowy(V))
🔽 Symbol strzałki w dół (↓) oznacza, że powstał osad, czyli substancja trudno rozpuszczalna, która wypada z roztworu.
💧 Co to są reakcje strąceniowe?
Reakcje strąceniowe to reakcje chemiczne, w których jednym z produktów jest substancja trudno rozpuszczalna lub praktycznie nierozpuszczalna w wodzie.
W wyniku takiej reakcji powstaje osad – substancja, która wypada z roztworu i opada na dno naczynia. Taki produkt oznacza się symbolem ↓.
🧪 Jak zapisać wzory substancji trudno rozpuszczalnych w wodzie?
Substancje trudno rozpuszczalne (np. AgCl – chlorek srebra(I)) zapisujemy cząsteczkowo, ponieważ nie ulegają dysocjacji jonowej – nie rozpuszczają się w wodzie.
📌 Przykład reakcji strąceniowej:
AgNO₃ (azotan(V) srebra(I)) + HCl (kwas chlorowodorowy) → AgCl ↓ (chlorek srebra(I)) + HNO₃ (kwas azotowy(V))
AgCl tworzy osad (⬇️), ponieważ jest trudno rozpuszczalny w wodzie.
🧪 Inne sposoby otrzymywania soli
Sole można otrzymać na wiele różnych sposobów – nie tylko z metali i kwasów. Oto inne ważne reakcje prowadzące do powstania soli:
✅ Reakcja soli z zasadą
✅ Reakcja soli z kwasem
✅ Reakcja soli z inną solą
✅ Reakcja metalu z niemetalem
Każda z tych reakcji prowadzi do powstania nowej soli – czasem z dodatkiem innych produktów, np. wody lub gazu.
💡 Ciekawostki o solach
🧂 Najprostszą i najtańszą metodą pozyskiwania NaCl (chlorku sodu) jest po prostu odparowanie wody morskiej. Tak powstaje sól kuchenna!
🔥 Sód spala się w chlorze, tworząc chlorek sodu. To widowiskowa reakcja, podczas której metal reaguje z żółtozielonym gazem tworząc… sól, którą dobrze znamy z kuchni!
Sole
Przykładowe zestawienia zadań
Przykładowe zestawienia zadań, które mogą być idealnym treningiem przed realnym sprawdzianem.
Pliki do pobrania w .pdf i wydrukowania TUTAJ
