Pochodne węglowodorów – odkryj związki, które zmieniają świat!
Witamy w dziale „Pochodne węglowodorów”, gdzie poznasz związki chemiczne powstające z węglowodorów, ale zawierające dodatkowe atomy – np. tlenu, azotu czy chloru. To właśnie pochodne węglowodorów tworzą alkohole, kwasy karboksylowe, estry i wiele innych substancji, które mają ogromne znaczenie w życiu codziennym – od zapachów i smaków po tworzywa sztuczne i lekarstwa. W tym dziale nauczysz się rozpoznawać grupy funkcyjne, nazywać związki i rozumieć ich właściwości. Gotowy? Przed Tobą fascynująca podróż przez świat chemii organicznej!
Pochodne węglowodorów
🧩 GRUPA ALKILOWA
Dla ucznia: Wyobraź sobie, że od cząsteczki alkanu (czyli zwykłego węglowodoru) odrywasz jeden atom wodoru. To, co zostaje, to właśnie grupa alkilowa.
Definicja szkolna: Grupa atomów powstająca przez odłączenie atomu wodoru od cząsteczki alkanu.
💡 GRUPA FUNKCYJNA
Dla ucznia: To taka specjalna „część” cząsteczki, która decyduje o tym, jak się zachowuje dany związek chemiczny – np. czy pachnie, czy się pieni, czy reaguje z innymi.
Definicja szkolna: Grupa atomów, która nadaje związkowi organicznemu charakterystyczne właściwości.
🍷 ALKOHOLE
Dla ucznia: Alkohole to cząsteczki, które mają specjalną grupę -OH. Można je spotkać w kosmetykach, lekach, a czasem też w napojach.
Definicja szkolna: Pochodne węglowodorów zawierające w cząsteczce grupę hydroksylową -OH.
💧 GRUPA HYDROKSYLOWA
Dla ucznia: To część cząsteczki alkoholu – składa się z tlenu i wodoru.
Definicja szkolna: Grupa funkcyjna alkoholi zbudowana z atomów tlenu i wodoru -OH.
1️⃣ ALKOHOLE MONOHYDROKSYLOWE
Dla ucznia: To alkohole, które mają tylko jedną grupę -OH.
Definicja szkolna: Alkohole zawierające w cząsteczce jedną grupę hydroksylową -OH.
➕ ALKOHOLE POLIHYDROKSYLOWE
Dla ucznia: To alkohole z więcej niż jedną grupą -OH.
Definicja szkolna: Alkohole zawierające w cząsteczce więcej niż jedną grupę hydroksylową -OH.
🧪 METANOL CH₃OH
Dla ucznia: Najprostszy alkohol – ma jedną grupę -OH.
Definicja szkolna: Pierwszy związek chemiczny w szeregu homologicznym alkoholi.
🍺 ETANOL C₂H₅OH
Dla ucznia: Alkohol etylowy – taki jak w napojach, powstaje w procesie fermentacji.
Definicja szkolna: Drugi związek chemiczny w szeregu homologicznym alkoholi. Powstaje w fermentacji alkoholowej.
🍞 FERMENTACJA ALKOHOLOWA
Dla ucznia: To taki proces, w którym np. drożdże zamieniają cukier w alkohol i gaz.
Definicja szkolna: Reakcja biochemiczna polegająca na powstawaniu etanolu z sacharydów np. z glukozy.
🔽 KONTRAKCJA
Dla ucznia: Gdy zmieszasz dwie ciecze i zrobi się ich mniej niż było osobno – to kontrakcja.
Definicja szkolna: Zmniejszenie objętości roztworu w wyniku zmieszania dwóch cieczy.
⚙️ ENZYMY (BIOKATALIZATORY)
Dla ucznia: To takie „pomocniki” w ciele, które przyspieszają reakcje – jak np. trawienie.
Definicja szkolna: Substancje (np. enzymy trawienne) regulujące przebieg reakcji biochemicznych. Wytwarzane przez organizmy.
🧪 GLICEROL (propano-1,2,3-triol) – C₃H₅(OH)₃
To alkohol trihydroksylowy, czyli taki, który zawiera trzy grupy -OH w cząsteczce.
📘 Definicja: Glicerol to alkohol, którego cząsteczka ma trzy grupy hydroksylowe – jest lepki i dobrze rozpuszcza się w wodzie.
🧪 KWASY KARBOKSYLOWE
To kwasy organiczne, czyli pochodne węglowodorów, które zawierają w cząsteczce grupę karboksylową -COOH.
📘 Definicja: Kwasy karboksylowe to związki zawierające grupę funkcyjną -COOH.
🧩 GRUPA KARBOKSYLOWA (-COOH)
To grupa funkcyjna zbudowana z atomów: węgla, wodoru i tlenu. Nadaje właściwości kwasowe całej cząsteczce.
🍃 KWAS METANOWY (KWAS MRÓWKOWY) – HCOOH
Pierwszy związek w szeregu kwasów karboksylowych – ma tylko jeden atom węgla.
🍃 KWAS ETANOWY (KWAS OCTOWY) – CH₃COOH
Drugi w szeregu – ma dwa atomy węgla. Powstaje np. podczas fermentacji octowej.
🧬 FERMENTACJA OCTOWA
To proces, w którym etanol zamienia się w kwas octowy, przy udziale enzymów bakterii octowych.
🧈 KWASY TŁUSZCZOWE
KWAS STEARYNOWY – C₁₇H₃₅COOH
KWAS PALMITYNOWY – C₁₅H₃₁COOH
➡️ To nasycone kwasy tłuszczowe – nie zawierają wiązań podwójnych.KWAS OLEINOWY – C₁₇H₃₃COOH
➡️ To nienasycony kwas tłuszczowy – ma jedno wiązanie podwójne.
🧼 MYDŁA
To sole wyższych kwasów karboksylowych, najczęściej sodowe lub potasowe. Powstają np. z kwasu stearynowego.
🧪 ESTRYFIKACJA
To reakcja chemiczna zachodząca między kwasem a alkoholem.
📘 Produkt: ester + woda
🧪 ESTER
Związek chemiczny, który powstaje w reakcji estryfikacji. Zawiera grupę estrową -COO-.
🧩 GRUPA ESTROWA –COO–
Grupa funkcyjna charakterystyczna dla estrów – łączy w sobie elementy pochodzące od kwasu i alkoholu.
🍖 AMINOKWASY
To pochodne węglowodorów zawierające dwie grupy funkcyjne:
grupę aminową -NH₂
grupę karboksylową -COOH
📘 To właśnie aminokwasy budują białka.
🔗 KONDENSACJA AMINOKWASÓW
To reakcja, w której łączą się aminokwasy, a wydziela się cząsteczka wody.
🧬 PEPTYDY
To cząsteczki powstające z połączenia aminokwasów – mniejsze fragmenty białek.
🧷 WIĄZANIE PEPTYDOWE
Wiązanie chemiczne, które łączy aminokwasy w cząsteczkach peptydów i białek.
🥚 BIAŁKA
To duże cząsteczki (polipeptydy), które składają się z wielu połączonych aminokwasów. Są niezbędne do życia – budują nasze ciała!
Pochodne węglowodorów – rodzaje alkoholi
🧪 Rodzaje alkoholi – jak się różnią?
Czy wszystkie alkohole są takie same? Nie! Niektóre z nich mają tylko jedną grupę -OH, a inne więcej niż jedną. To właśnie na tej podstawie dzielimy alkohole na monohydroksylowe i polihydroksylowe.
👧 Prosto i zrozumiale:
🔹 Alkohole monohydroksylowe mają jedną „łapkę” -OH, dzięki której mogą łączyć się z innymi cząsteczkami. Przykład? Etanol, czyli alkohol, który znajduje się np. w napojach alkoholowych (choć oczywiście nie dla dzieci! 😉).
🔹 Alkohole polihydroksylowe to takie, które mają więcej łapek -OH – czyli więcej niż jedną. Dzięki temu mogą tworzyć jeszcze więcej połączeń. Przykład? Glicerol, który znajdziesz np. w kosmetykach i maściach, bo świetnie zatrzymuje wodę i nawilża skórę.
📘 Definicje szkolne:
| Rodzaj alkoholu | Opis |
|---|---|
| Monohydroksylowe | Zawierają w cząsteczce jedną grupę hydroksylową (-OH). Przykłady: metanol, etanol. |
| Polihydroksylowe | Zawierają w cząsteczce co najmniej dwie grupy -OH, z których każda jest połączona z innym atomem węgla. Przykład: glicerol. |
🧪 Jak się tworzy nazwy alkoholi?
👧 Prosto i zrozumiale:
Nazwy alkoholi mogą brzmieć trochę tajemniczo, ale zasady ich tworzenia są naprawdę proste!
🔹 Nazwa systematyczna powstaje przez wzięcie nazwy węglowodoru i dodanie końcówki -ol.
👉 Na przykład: pentan → pentanol
🔹 Nazwa zwyczajowa to taka bardziej „codzienna”. Tworzy się ją, dodając słowo alkohol oraz nazwę grupy alkilowej (czyli cząstki pochodzącej od węglowodoru) i końcówkę -owy.
👉 Na przykład: alkohol pentylowy
📘 Definicja szkolna:
Nazwy systematyczne alkoholi tworzy się od nazw węglowodorów, dodając końcówkę -ol.
Nazwy zwyczajowe powstają przez dodanie do słowa alkohol nazwy grupy alkilowej i końcówki -owy.
| Nazwa węglowodoru | Nazwa systematyczna alkoholu | Nazwa grupy alkilowej | Nazwa zwyczajowa alkoholu |
|---|---|---|---|
| metan | metanol | metyl | alkohol metylowy |
| etan | etanol | etyl | alkohol etylowy |
| propan | propanol | propyl | alkohol propylowy |
| butan | butanol | butyl | alkohol butylowy |
| pentan | pentanol | pentyl | alkohol pentylowy |
🧪 Szereg homologiczny alkoholi – co to takiego?
👧 Prosto i zrozumiale:
Alkohole można ułożyć w kolejności – od najprostszego (czyli z najmniejszą liczbą atomów węgla) do bardziej „rozbudowanych”. Każdy kolejny alkohol ma w cząsteczce o jeden atom węgla więcej niż poprzedni. To trochę jak budowanie wieży – dokładasz kolejny klocek i powstaje nowa, wyższa forma. Ten „ciąg” nazywamy szeregiem homologicznym.
📘 Definicja szkolna:
Szereg homologiczny alkoholi to uporządkowany zbiór alkoholi, w którym każdy kolejny związek chemiczny różni się od poprzedniego o jedną grupę –CH₂ (czyli o jeden atom węgla i dwa atomy wodoru). W cząsteczkach alkoholi liczba atomów węgla wzrasta, a wszystkie mają tę samą grupę funkcyjną –OH.
🔣 Jak zapisać wzór ogólny alkoholi?
Wzór ogólny alkoholi:
R–OH
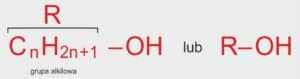
Gdzie:
R – grupa alkilowa (czyli „ogonek” pochodzący od węglowodoru),
–OH – grupa hydroksylowa,
n – liczba naturalna określająca liczbę atomów węgla w cząsteczce alkoholu (n > 0).
SZEREG HOMOLOGICZNY ALKOHOLI - PRZYKŁADY
Podane przykłady są do pięciu atomów węgla w cząsteczce.
LICZBA ATOMÓW WĘGLA W CZĄSTECZCE | WZÓR STRUKTURALNY I NAZWA ALKANU | WZÓR I NAZWA ALKILU | WZÓR ALKOHOLU | WZÓR SUMARYCZNY I NAZWY ALKOHOLU | ||
| STRUKTURALNY | PÓŁSTRUKTURALNY | GRUPOWY | ||||
| 1 | 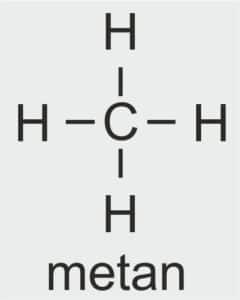 | CH3 – METYL | 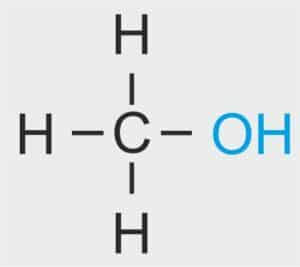 | CH3 – OH | CH3 (OH) | CH3 (OH) metanol/alkohol metylowy |
| 2 | 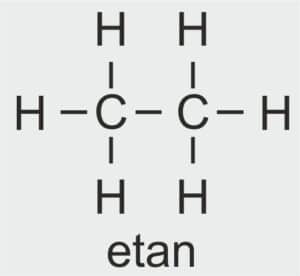 | C2H5 – ETYL | 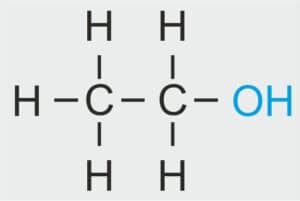 | CH3 – CH2 – OH | CH3 CH2 (OH) | C2H5OH Etanol/alkohol etylowy |
| 3 | 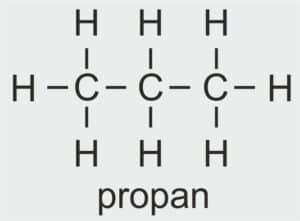 | C3H7 – PROPYL | 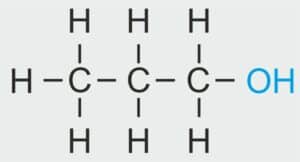 | CH3 – CH2 – CH2 – OH | CH3 (CH2)2 OH | C3H7OH Propanol/alkohol propylowy |
| 4 | 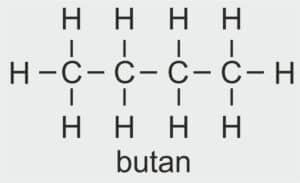 | C4H9 – BUTYL | 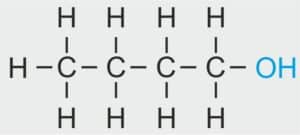 | CH3 – CH2 – CH2 – CH2 – OH | CH3 (CH2)3 OH | C4H9OH Butanol/alkohol butylowy |
| 5 | 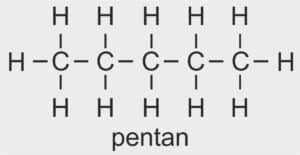 | C5H11 – PENTYL | 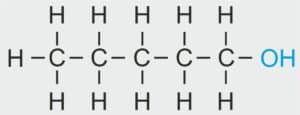 | CH3 –CH2 – CH2 – CH2 – CH2 – OH | CH3 (CH2)4 OH | C5H11OH Pentanol/alkohol pentylowy |
🍇 Na czym polega fermentacja alkoholowa?
🧠 W prostych słowach:
Fermentacja alkoholowa to proces, w którym z cukru (np. glukozy) powstaje alkohol i gaz – tlenek węgla(IV).
Dzieje się to dzięki drożdżom, czyli żywym organizmom, które produkują specjalne enzymy potrzebne do tej przemiany.
🧪 Definicja szkolna:
Fermentacja alkoholowa to proces biochemiczny polegający na rozkładzie sacharydów (np. glukozy) do etanolu i tlenku węgla(IV), zachodzący w warunkach beztlenowych pod wpływem enzymów produkowanych przez drożdże.

🍷 Dlaczego winogrona łatwo ulegają fermentacji?
Winogrona zawierają dużo glukozy (cukru), który może zostać rozłożony na alkohol.
Na skórkach winogron znajdują się naturalne drożdże, które wydzielają enzymy potrzebne do rozpoczęcia fermentacji.
⏳ W jakich warunkach zachodzi fermentacja alkoholowa?
Fermentacja alkoholowa:
zachodzi w warunkach beztlenowych (czyli bez dostępu tlenu),
może trwać nawet kilka tygodni,
przebiega w obecności drożdży, które uruchamiają reakcję rozkładu cukrów.
🧪 Równanie fermentacji alkoholowej:
Graficzny wzór, który masz, przedstawia zapewne tę reakcję:
C₆H₁₂O₆ → 2 C₂H₅OH + 2 CO₂
(glukoza → etanol + tlenek węgla(IV))
pierwszy alkohol w szeregu homologicznych
🧪 Właściwości i zastosowanie metanolu (CH₃OH)
Metanol to najprostszy alkohol, należący do grupy alkoholi monohydroksylowych. Ze względu na swoje właściwości chemiczne i fizyczne znajduje szerokie zastosowanie w przemyśle, ale jest również bardzo niebezpieczny dla zdrowia człowieka.
| Właściwości fizyczne | Właściwości chemiczne |
|---|---|
| – ciecz lotna; – bezbarwny; – bardzo dobrze miesza się z wodą. | – silnie trujący; – ma charakterystyczny zapach; – ulega reakcjom spalania. |
🧴 Metanol – zastosowanie
Choć metanol (CH₃OH) jest silnie trujący, ma wiele zastosowań w przemyśle i laboratoriach. Dzięki swoim właściwościom znajduje się w różnych produktach i procesach technologicznych.
✅ Gdzie stosuje się metanol?
🧽 Rozpuszczalnik – świetnie rozpuszcza farby, lakiery i tłuszcze.
🔬 Tworzywa sztuczne – wykorzystywany do produkcji różnych materiałów.
🧼 Środek skażający – dodawany np. do detergentów, by nie nadawały się do spożycia.
🧫 Formalina – stosowany do konserwowania preparatów biologicznych.
🧪 Właściwości i zastosowanie etanolu (C₂H₅OH)
Etanol to jeden z najczęściej wykorzystywanych alkoholi, należący do grupy alkoholi monohydroksylowych. Znajduje zastosowanie w przemyśle spożywczym, farmaceutycznym i kosmetycznym. Choć może być stosowany przez ludzi, w nadmiarze jest szkodliwy i niebezpieczny dla zdrowia.
📘 Właściwości etanolu (C₂H₅OH)
| Właściwości fizyczne | Właściwości chemiczne |
|---|---|
| – ciecz lotna; – bezbarwny; – ma gęstość mniejszą od gęstości wody; – bardzo dobrze miesza się z wodą (podczas mieszania zachodzi zjawisko kontrakcji). | – ma charakterystyczny zapach; – odczyn obojętny (alkohol nie ulega dysocjacji jonowej); – ulega reakcjom spalania; – ścina białko; – reakcją charakterystyczną etanolu jest reakcja z K2Cr2O7 w obecności stężonego roztworu H2SO4. |
🍶 Etanol – zastosowanie
🧴 Dezynfekcja: dzięki właściwościom bakteriobójczym stosowany w preparatach do dezynfekcji i środkach czyszczących.
🥃 Przemysł spożywczy: wykorzystywany do produkcji octu oraz jako składnik napojów alkoholowych (wódki, likiery).
💄 Przemysł kosmetyczny: stężony roztwór etanolu to baza najtrwalszych perfum.
💊 Przemysł farmaceutyczny: składnik kropli nasercowych, żołądkowych i wielu innych leków.
⚠️ Wpływ etanolu na organizm człowieka
Nawet niewielka ilość może uszkadzać układ nerwowy oraz organy wewnętrzne (żołądek, wątroba, trzustka, serce).
Nadmierne spożycie prowadzi do alkoholizmu – poważnej choroby uzależniającej.
Skutki długotrwałego nadużywania etanolu:
zaburzenia pamięci,
trwałe zmiany w mózgu,
rak przełyku,
uszkodzenie mięśnia sercowego,
nieodwracalne uszkodzenia wątroby,
stany zapalne i owrzodzenia żołądka.
💧 Co to jest kontrakcja? – wyjaśnienie dla ucznia
Czasem, gdy zmieszasz dwie ciecze (np. wodę i alkohol), zauważysz, że po połączeniu ich objętość jest mniejsza niż suma objętości tych cieczy przed zmieszaniem. To trochę tak, jakby część cieczy gdzieś „zniknęła” – ale tak naprawdę ich cząsteczki po prostu ściślej się ułożyły.
📘 Definicja szkolna
Kontrakcja – to zmniejszenie objętości roztworu powstałego przez zmieszanie dwóch cieczy. Objętość końcowa jest mniejsza niż suma objętości cieczy przed zmieszaniem, ponieważ cząsteczki cieczy wnikają między siebie i układają się bliżej.
Przykład:
Zmieszanie 50 ml wody i 50 ml etanolu daje mniej niż 100 ml roztworu.
🧪 Jak się tworzy nazwę systematyczną glicerolu?
🧒 Dla ucznia:
Glicerol to alkohol, który ma trzy grupy -OH (czyli jest polihydroksylowy). Jego nazwa systematyczna pochodzi od nazwy węglowodoru propan, bo cząsteczka glicerolu zawiera trzy atomy węgla. Do każdego z tych atomów przyłączona jest jedna grupa -OH, dlatego używa się liczby 1,2,3 w nazwie.
📘 Definicja szkolna:
Nazwę systematyczną glicerolu tworzy się od nazwy alkanu propan, dodając końcówkę „triol” oraz cyfry określające położenie grup hydroksylowych.
Systematyczna nazwa glicerolu: propano-1,2,3-triol
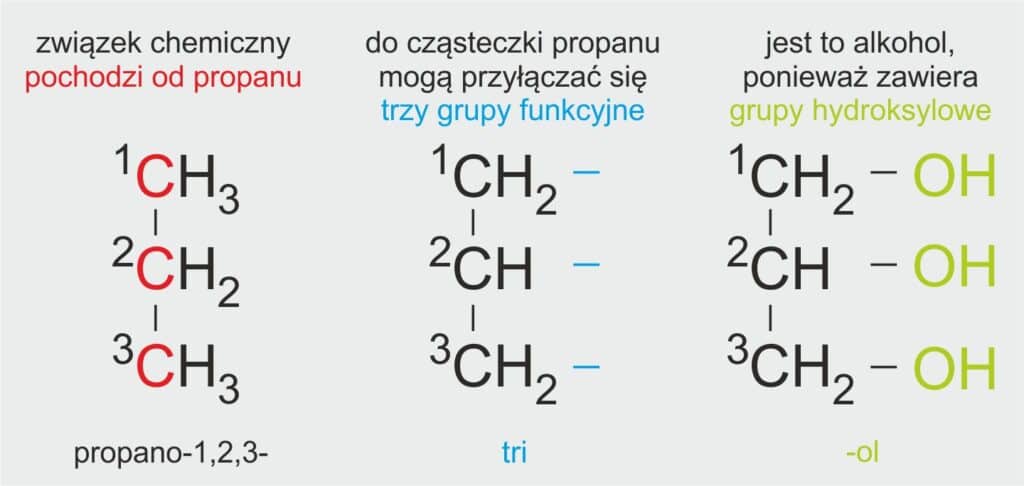
🌡️ Właściwości glicerolu C₃H₅(OH)₃
| WŁAŚCIWOŚCI FIZYCZNE | WŁAŚCIWOŚCI CHEMICZNE |
|---|---|
| – ciecz; – bezbarwny; – bardzo dobrze rozpuszcza się w wodzie; – higroskopijny; – ma gęstość większą od gęstości wody. | – bezwonny; – słodki smak; – odczyn obojętny; – ulega reakcjom spalania. |
- Nitrogliceryna – związek glicerolu stosowany jako lek w chorobach serca.
- Garbarstwo – używany do zmiękczania skóry.
- Przemysł farmaceutyczny – składnik leków, np. syropów przeciwkaszlowych.
- Przemysł spożywczy – wykorzystywany przy produkcji suszonych owoców i wyrobów cukierniczych.
- Poligrafia – substrat do produkcji farb drukarskich.
🧴 ALKOHOLE WYŻSZE – ZASTOSOWANIE
Stosuje się je w przemyśle:
- chemicznym
- farmaceutycznym
- kosmetycznym
- tworzyw sztucznych
| Nazwa | Zastosowanie |
|---|---|
| Mentol | Używany m.in. w kremach i produktach do higieny jamy ustnej; główny składnik olejku miętowego. |
| Cytronelol | Stosowany w mydłach, środkach czystości, odświeżaczach powietrza; składnik olejków z melisy i liści cytryny. |
| Geraniol | Wykorzystywany w środkach przeciw komarom; główny składnik olejku różanego. |
| Retinol (wit. A) | Używany w leczeniu niedoborów witaminy A i chorób skóry. |
RODZAJE KWASÓW
| KWASY ORGANICZNE | KWASY NIEORGANICZNE |
|---|---|
| – pochodne węglowodorów; – wiele z nich występuje naturalnie w środowisku przyrodniczym (np. kwas szczawiowy, kwas cytrynowy). | – grupa związków, które mogą ulegać różnym reakcjom, np. dysocjacji lub reakcjom z aktywnymi metalami; – przykłady: kwas chlorowodorowy, kwas siarkowy(VI). |
JAK SIĘ TWORZY NAZWY KWASÓW KARBOKSYLOWYCH?
🧪 Jak się tworzy nazwy kwasów karboksylowych?
👉 Prosto mówiąc:
Nazwy systematyczne tych kwasów powstają od nazw węglowodorów (czyli związków zbudowanych z węgla i wodoru). Jeśli cząsteczka kwasu ma np. 3 atomy węgla, patrzymy na węglowodór o 3 atomach węgla – czyli propan. Do jego nazwy dodajemy słowo kwas oraz końcówkę -owy. Tak powstaje nazwa: kwas propanowy.
✏️ Nazwy zwyczajowe często pochodzą od miejsca występowania lub zastosowania, np. kwas mrówkowy (bo występuje w jadzie mrówek), czy kwas octowy (bo jest w occie).
| NAZWA WĘGLOWODORU | NAZWA SYSTEMATYCZNA KWASU KARBOKSYLOWEGO |
|---|---|
| propan | kwas propanowy |
| pentan | kwas pentanowy |
SZEREG HOMOLOGICZNY KWASÓW KARBOKSYLOWYCH
metan
Podane przykłady są do pięciu atomów węgla w cząsteczce (metan, etan, propan, butan, pentan).
NAZWA ALKANU: METAN
WZÓR STRUKTURALNY:

LICZBA ATOMÓW WĘGLA W CZĄSTECZCE ALKANU: 1
LICZBA ATOMÓW WĘGLA W CZĄSTECZCE KWASU KARBOKSYLOWEGO: 1
NAZWA SYSTEMATYCZNA: kwas metanowy
NAZWA ZWYCZAJOWA: kwas mrówkowy
WZORY:
| Wzór strukturalny | Wzór półstrukturalny | Wzór grupowy | Wzór sumaryczny |
|---|---|---|---|
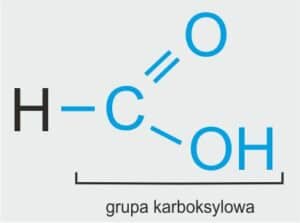 H–COOH H–COOH | H–COOH | HCOOH | HCOOH lub CH2O2 |
etan
NAZWA ALKANU: ETAN
WZÓR STRUKTURALNY:

LICZBA ATOMÓW WĘGLA W CZĄSTECZCE ALKANU: 2
LICZBA ATOMÓW WĘGLA W CZĄSTECZCE KWASU KARBOKSYLOWEGO: 2
NAZWA SYSTEMATYCZNA: kwas etanowy
NAZWA ZWYCZAJOWA: kwas octowy
WZORY:
| Wzór strukturalny | Wzór półstrukturalny | Wzór grupowy | Wzór sumaryczny |
|---|---|---|---|
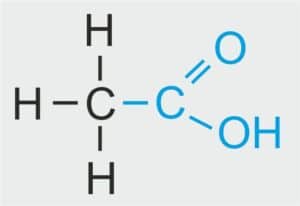 CH3–COOH CH3–COOH | CH3 – CH2 – COOH | CH3COOH | CH3COOH lub C2H4O2 |
propan
NAZWA ALKANU: PROPAN
WZÓR STRUKTURALNY:

LICZBA ATOMÓW WĘGLA W CZĄSTECZCE ALKANU: 3
LICZBA ATOMÓW WĘGLA W CZĄSTECZCE KWASU KARBOKSYLOWEGO: 3
NAZWA SYSTEMATYCZNA: kwas propanowy
NAZWA ZWYCZAJOWA: kwas propionowy
WZORY:
| Wzór strukturalny | Wzór półstrukturalny | Wzór grupowy | Wzór sumaryczny |
|---|---|---|---|
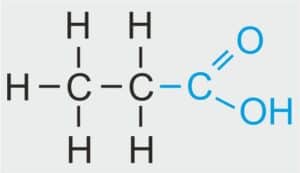 CH3–CH2–COOH CH3–CH2–COOH | CH3CH2COOH | CH3CH2COOH | C3H6O2 |
butan
NAZWA ALKANU: BUTAN
WZÓR STRUKTURALNY:

LICZBA ATOMÓW WĘGLA W CZĄSTECZCE ALKANU: 4
LICZBA ATOMÓW WĘGLA W CZĄSTECZCE KWASU KARBOKSYLOWEGO: 4
NAZWA SYSTEMATYCZNA: kwas butanowy
NAZWA ZWYCZAJOWA: kwas masłowy
WZORY:
| Wzór strukturalny | Wzór półstrukturalny | Wzór grupowy | Wzór sumaryczny |
|---|---|---|---|
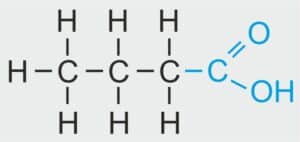 CH₃–CH₂–CH₂–COOH CH₃–CH₂–CH₂–COOH | CH3 – CH2 – CH2 – COOH | C₃H₇COOH | C₄H₈O₂ |
pentan
NAZWA ALKANU: PENTAN
WZÓR STRUKTURALNY:

LICZBA ATOMÓW WĘGLA W CZĄSTECZCE ALKANU: 5
LICZBA ATOMÓW WĘGLA W CZĄSTECZCE KWASU KARBOKSYLOWEGO: 5
NAZWA SYSTEMATYCZNA: kwas pentanowy
NAZWA ZWYCZAJOWA: kwas walerianowy
WZORY:
| Wzór strukturalny | Wzór półstrukturalny | Wzór grupowy | Wzór sumaryczny |
|---|---|---|---|
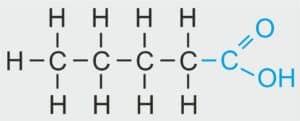 CH₃–CH₂–CH₂–CH₂–COOH CH₃–CH₂–CH₂–CH₂–COOH | CH3 –CH2 – CH2 – CH2 – COOH | CH3 (CH2)3 COOH | C₅H₁₀O₂ |
🧪 Jak zapisać wzór ogólny kwasów karboksylowych?
🟢 Wersja uproszczona (dla ucznia):
Każdy kwas karboksylowy ma w swojej cząsteczce grupę -COOH (to grupa kwasowa), która jest dołączona do jakiegoś „łańcuszka węglowego” – czyli do grupy atomów węgla i wodoru. Taki łańcuszek to właśnie grupa alkilowa i zapisujemy ją jako R.
📘 Definicja szkolna:
Wzór ogólny kwasów karboksylowych to:
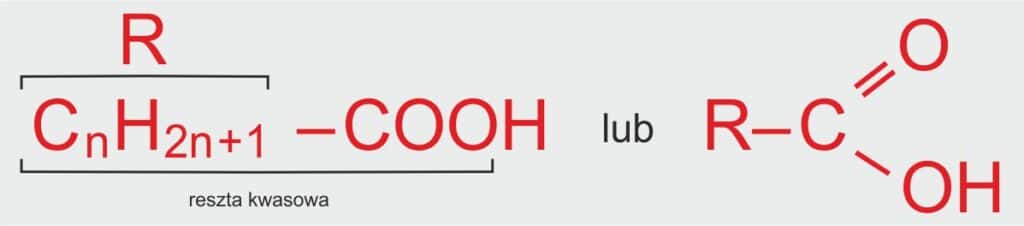
R–COOH, gdzie R to grupa alkilowa, czyli reszta węglowodorowa pochodząca od alkanu, a –COOH to grupa karboksylowa, która nadaje związkom właściwości kwasowe.
ℹ️ Dodatkowe informacje:
R – grupa alkilowa,
n – liczba naturalna oznaczająca liczbę atomów węgla w grupie alkilowej (n > 0).
KWAS METANOWY - HCOOH (MRÓWKOWY) właściwości
| WŁAŚCIWOŚCI FIZYCZNE | WŁAŚCIWOŚCI CHEMICZNE |
|---|---|
| – ciecz; – bezbarwny; – bardzo dobrze rozpuszcza się w wodzie. | – ma ostry, duszący zapach; – trujący; – powoduje oparzenia; – ulega reakcjom spalania; – ulega reakcji dysocjacji jonowej. |
🧪 Kwas metanowy – zastosowanie:
- Garbarstwo – środek zmiękczający podczas wyprawiania skór.
- Pszczelarstwo – pomocny w zwalczaniu pasożytów pszczół.
- Konserwacja żywności – właściwości bakteriobójcze wykorzystuje się do:
- przedłużania trwałości karmy,
- dezynfekcji beczek na wino i piwo.
- Przemysł kosmetyczny – składnik preparatów przeciwłupieżowych.
JAK OTRZYMAĆ KWAS ETANOWY?
🧪 Jak otrzymać kwas etanowy?
Kwas etanowy (CH3COOH), znany też jako kwas octowy, można otrzymać w naturalny sposób w procesie fermentacji octowej.
🔬 Na czym polega fermentacja octowa?
To złożony proces biochemiczny polegający na utlenianiu etanolu (alkoholu etylowego) do kwasu etanowego. Proces ten zachodzi pod wpływem enzymów wytwarzanych przez bakterie octowe.
📘 Równanie reakcji fermentacji octowej:
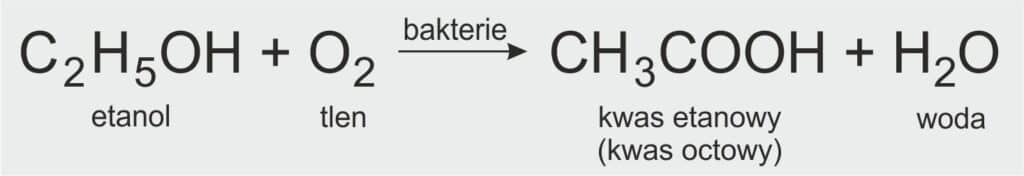
C2H5OH + O2 → CH3COOH + H2O
Etanol + tlen → kwas etanowy + woda
Jak się tworzy nazwy soli kwasów karboksylowych
Nazwy soli kwasów karboksylowych tworzy się, dodając do nazwy reszty kwasowej nazwę metalu, uwzględniając jego wartościowość (jeśli może przyjmować różne).
Nazwy soli często mają też swoje zwyczajowe odpowiedniki, które pochodzą od tradycyjnych nazw kwasów.
| 🧪 Nazwa kwasu karboksylowego | 🧾 Nazwa soli |
|---|---|
| kwas metanowy (kwas mrówkowy) | metanian… (mrówczan…) |
| kwas etanowy (kwas octowy) | etanian… (octan…) |
| kwas butanowy (kwas masłowy) | butanian… (maślan…) |
właściwości fizyczne i chemiczne kwasu etanowego (CH₃COOH)
| Właściwości fizyczne | Właściwości chemiczne |
|---|---|
| – ciecz; – bezbarwny; – bardzo dobrze rozpuszcza się w wodzie. | – ma charakterystyczny zapach; – wykazuje odczyn kwasowy; – ulega dysocjacji jonowej; – reaguje z metalami aktywnymi, tlenkami metali i zasadami, tworząc sole; – ulega reakcjom spalania. |
🧴 Kwas etanowy – zastosowanie
🧵 Produkcja tworzyw sztucznych, np. sztucznego jedwabiu
🎨 Produkcja barwników, substancji zapachowych i rozpuszczalników
🍱 Przemysł spożywczy – do konserwowania potraw
🎬 Taśmy filmowe – stosowany przy tworzeniu taśm do obrazów 3D
💊 Przemysł farmaceutyczny – wykorzystywany np. do produkcji aspiryny
WYŻSZE KWASY KARBOKSYLOWE
🧪 Co to są wyższe kwasy karboksylowe?
🧸 Dla ucznia (prosto i zrozumiale):
Wyższe kwasy karboksylowe to takie kwasy, które mają długi łańcuch węglowy. Często nazywa się je kwasami tłuszczowymi, ponieważ można je uzyskać z tłuszczów roślinnych i zwierzęcych.
🍽️ Występują np. w margarynie, olejach, tłuszczu do smażenia i… w mydle!
📘 Definicja szkolna:
Wyższe kwasy karboksylowe to kwasy organiczne, których cząsteczki zawierają więcej niż 8 atomów węgla w długim łańcuchu węglowym. Nazywane są również kwasami tłuszczowymi, ponieważ można je wyodrębnić z tłuszczów naturalnych.
🔬 Przykłady wyższych kwasów karboksylowych:
kwas palmitynowy – C₁₅H₃₁COOH
kwas stearynowy – C₁₇H₃₅COOH
kwas oleinowy – C₁₇H₃₃COOH
🧴 Wyższe kwasy karboksylowe – zastosowanie
🧸 Dla ucznia (prosto i zrozumiale):
Wyższe kwasy karboksylowe, czyli kwasy tłuszczowe, wykorzystuje się do tworzenia rzeczy, które dobrze znasz – np. świec, kosmetyków czy produktów z gumy. Dzięki nim pomadki nie wysychają, świece się nie kruszą, a guma jest trwalsza.
📘 Definicja szkolna:
Wyższe kwasy karboksylowe znajdują szerokie zastosowanie w przemyśle ze względu na swoje właściwości hydrofobowe i reaktywność chemiczną.
Zastosowanie wyższych kwasów karboksylowych
| Zastosowanie | Branża |
|---|---|
| Produkcja świec (np. stearyna) | Przemysł chemiczny |
| Zwiększanie trwałości wyrobów gumowych | Przemysł gumowy |
| Produkcja pomadek ochronnych i pianek do golenia | Przemysł kosmetyczny |
📘 Rodzaje kwasów karboksylowych
🧠 Dla ucznia (prosto i zrozumiale):
Kwasy karboksylowe mogą mieć krótkie, średnie albo długie „ogonki” z atomów węgla – czyli różną długość łańcucha węglowego. Te krótkie szybko się rozpuszczają i często mają ostry zapach, a te dłuższe np. w tłuszczach – są bardziej tłuste i mniej lotne.
📚 Definicja szkolna:
Kwasy karboksylowe dzieli się ze względu na długość łańcucha węglowego na niższe, średnie i wyższe. Długość łańcucha wpływa na ich właściwości fizyczne (np. rozpuszczalność, stan skupienia).
| Rodzaj | Przykład | Charakterystyka |
|---|---|---|
| Niższe kwasy karboksylowe | kwas mrówkowy (HCOOH) | krótkie łańcuchy, dobrze rozpuszczalne w wodzie, o ostrym zapachu |
| Kwasy o średniej długości łańcucha | kwas masłowy (C3H7COOH) | średnia rozpuszczalność, nieprzyjemny zapach |
| Wyższe kwasy karboksylowe | kwas palmitynowy (C15H31COOH) | długie łańcuchy, stałe w temperaturze pokojowej, tłuszczowe |
mydła
🧼 Co to są mydła?
🧠 Dla ucznia (prosto i zrozumiale):
Mydła to specjalne związki, które powstają z kwasów tłuszczowych i metali. Dzięki nim możemy się myć i usuwać brud. Mydła sodowe są twarde – to właśnie te kostki mydła, które dobrze znamy z łazienki. Mydła potasowe są bardziej miękkie i maziste, np. szare mydła. Mydła z innymi metalami są trudne do rozpuszczenia w wodzie, dlatego nie nadają się do codziennego użytku.
📚 Definicja szkolna:
Mydła to sole wyższych kwasów karboksylowych, np. kwasu palmitynowego, stearynowego lub oleinowego. Mydła dobrze rozpuszczalne w wodzie to sole sodowe i potasowe. Sole innych metali są trudno rozpuszczalne i nie mają zastosowania użytkowego.
Rodzaje mydeł i ich właściwości
| Rodzaj mydła | Metal | Wygląd | Rozpuszczalność w wodzie | Zastosowanie |
|---|---|---|---|---|
| Mydło sodowe | Sód (Na) | Białe, twarde | Dobrze rozpuszczalne | Mydła toaletowe |
| Mydło potasowe | Potas (K) | Szare, maziste | Dobrze rozpuszczalne | Mydła gospodarcze, szare |
| Mydła z innymi metalami | np. wapń, magnez | Twarde, osad | Trudno rozpuszczalne | Brak zastosowania toaletowego |
WŁAŚCIWOŚCI KWASÓW KARBOKSYLOWYCH
| Właściwość | Niższe kwasy karboksylowe | Wyższe kwasy karboksylowe |
|---|---|---|
| Stan skupienia | Substancje ciekłe | Substancje stałe |
| Jakim reakcjom ulegają? |
Ulegają reakcjom z: – metalami aktywnymi chemicznie; – tlenkami metali; – zasadami. | Reagują z zasadami |
| Czy są palne? | Tak | Tak |
| Rozpuszczalność w wodzie | Dobrze rozpuszczają się w wodzie | Nie rozpuszczają się w wodzie |
| Czy ulegają dysocjacji jonowej? | Tak | Nie |
zastosowania kwasów organicznych
Kwasy organiczne – zastosowanie:
- Kwas szczawiowy – stosowany do garbowania skór i barwienia tkanin.
- Kwas cytrynowy – działa rozjaśniająco na cerę, używany w peelingach i kosmetykach.
- Kwas jabłkowy – wykorzystywany do zakwaszania produktów spożywczych, np. cukierków.
nazwy estrów
JAK SIĘ TWORZY NAZWY ESTRÓW?
🔬 Nazwy estrów składają się z dwóch części. Pierwsza pochodzi od nazwy kwasu karboksylowego (z końcówką -an), a druga od nazwy alkoholu (czyli grupy alkilowej).
| Nazwa kwasu karboksylowego | Nazwa alkoholu | Nazwa alkilu | Nazwa estru |
|---|---|---|---|
| kwas metanowy | metanol | metyl | metanian metylu |
WZÓR OGÓLNY ESTRÓW
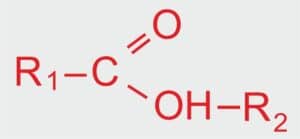
R1 – alkil pochodzący od kwasu karboksylowego,
R2 – alkil pochodzący od alkoholu.
właściwości i zastosowanie ESTRÓW
| Właściwości estrów |
|---|
| – bezbarwne |
| – lotne ciecze |
| – słabo rozpuszczalne w wodzie |
| – mają kwiatowy lub owocowy zapach |
| – dobre rozpuszczalniki |
| – ulegają reakcji spalania |
| Zastosowanie estrów |
|---|
| – przemysł kosmetyczny (rozpuszczalniki i substancje zapachowe, np. płyny do kąpieli) |
| – przemysł spożywczy (dodatki zapobiegające mętnieniu płynnych sosów) |
| – aromaty, np. butanian butylu – zapach ananasa |
🧬 Co to są aminokwasy?
Aminokwasy to wyjątkowe związki organiczne, których cząsteczki zawierają dwie grupy funkcyjne:
💠 Grupę aminową:
-NH₂💠 Grupę karboksylową:
-COOH
To właśnie obecność tych dwóch grup sprawia, że aminokwasy pełnią tak ważną rolę w organizmach żywych – budują białka!
🔍 Aminokwasy – właściwości
🧊 Substancje stałe
💎 Mają budowę krystaliczną
💧 Dobrze rozpuszczalne w wodzie
🧪 Aminokwasy – zastosowanie
🍬 Przemysł spożywczy – składniki słodzików (zamiast cukru)
💄 Przemysł kosmetyczny – składniki kremów i kosmetyków pielęgnacyjnych
💡 Ciekawostki – jakie aminokwasy pomagają w pielęgnacji?
🧴 Glicyna – składnik środków przeciwłupieżowych
💆♀️ Cystyna, cysteina, metionina – regenerują, odżywiają i wzmacniają włosy
🩹 Lizyna – pobudza tkanki do regeneracji
🧪 Asparagina i kwas glutaminowy – regulują pH naskórka
🧼 Treonina – wspiera naturalne złuszczanie się naskórka
🧪 Jak przebiega reakcja kondensacji?
Reakcja kondensacji to sposób łączenia się aminokwasów.
🔬 Co się dzieje?
👉 Grupa karboksylowa -COOH jednej cząsteczki aminokwasu łączy się z grupą aminową -NH₂ drugiej cząsteczki.
➡️ W wyniku tej reakcji powstaje:
Wiązanie peptydowe
Cząsteczka wody
H₂O💧
🧩 Jakie pierwiastki tworzą wiązanie peptydowe?
W tworzeniu wiązania peptydowego biorą udział:
🧬 Węgiel (C)
💧 Tlen (O)
🌬️ Azot (N)
🔥 Wodór (H)
🧷 Jak powstają peptydy?
Peptydy powstają, gdy aminokwasy łączą się w dłuższe łańcuchy:
🧪 2 aminokwasy → dipeptyd
🧪 3 aminokwasy → tripeptyd
🧪 więcej aminokwasów → oligopeptyd / polipeptyd
Im więcej aminokwasów, tym dłuższy i bardziej złożony jest łańcuch peptydowy.
🧬 Co to są polipeptydy?
Polipeptydy to długie łańcuchy złożone z wielu aminokwasów połączonych ze sobą wiązaniami peptydowymi.
📌 Można je uznać za prototypy białek, bo to właśnie z nich zbudowane są białka w naszym ciele!
Pochodne węglowodorów
Przykładowe zestawienia zadań
Przykładowe zestawienia zadań, które mogą być idealnym treningiem przed realnym sprawdzianem.
Pliki do pobrania w .pdf i wydrukowania TUTAJ
Polipeptydy to długie łańcuchy złożone z wielu aminokwasów połączonych ze sobą wiązaniami peptydowymi.
📌 Można je uznać za prototypy białek, bo to właśnie z nich zbudowane są białka w naszym ciele!
