Łączenie się atomów – zobacz, jak powstają nowe substancje!
Łączenie się atomów to niezwykły proces, dzięki któremu powstają cząsteczki i związki chemiczne – od zwykłej wody po skomplikowane leki. W tym dziale dowiesz się, jak atomy „trzymają się za ręce” i tworzą trwałe połączenia. Poznasz rodzaje wiązań chemicznych, nauczysz się zapisywać równania reakcji chemicznych, odczytywać symbole i liczby w równaniach oraz rozumieć, co oznaczają pojęcia takie jak substraty i produkty. Zobaczysz też, jak to, co zapisane w jednym równaniu, może zmieniać cały świat!
Łączenie się atomów
🔢 Co to jest oktet elektronowy?
🧠 Dla zrozumienia:
Wyobraź sobie, że każdy atom chce mieć „pełne kółko” – czyli 8 elektronów na ostatniej powłoce. Dlaczego? Bo wtedy czuje się stabilny i bezpieczny – jakby miał zapięty pas bezpieczeństwa! 🚗✨
To właśnie nazywamy oktetem elektronowym. Atom dąży do tego, by mieć 8 elektronów na ostatniej powłoce, bo wtedy zachowuje się spokojnie i nie chce już niczego zmieniać.
📘 Definicja szkolna:
Oktet elektronowy to konfiguracja elektronowa, w której atom ma osiem elektronów walencyjnych na powłoce walencyjnej.
👯♀️ Co to jest dublet elektronowy?
🧠 Dla zrozumienia:
Niektóre małe atomy, jak hel czy wodór, nie potrzebują ósemki, wystarczą im dwa elektrony, żeby poczuć się dobrze. To jakby miały swoją „małą wersję bezpieczeństwa” – wystarczy dublet, czyli 2 elektrony walencyjne.
📘 Definicja szkolna:
Dublet elektronowy to konfiguracja elektronowa, w której atom ma dwa elektrony walencyjne na powłoce walencyjnej – taką konfigurację osiągają np. wodór i hel.
💬 Dlaczego atomy łączą się ze sobą?
🧠 Dla zrozumienia:
Wyobraź sobie, że atomy to ludzie, którzy chcą czuć się bezpiecznie. Każdy z nich marzy o tym, by mieć pełną „elektronową tarczę ochronną”! 🛡️
Dla większości atomów oznacza to 8 elektronów na ostatniej powłoce – to tak zwany oktet elektronowy. Kiedy atom go osiąga, jest spokojny i nie potrzebuje się już łączyć z innymi.
Ale są wyjątki! Niektórym wystarczą tylko 2 elektrony – to tzw. dublet elektronowy (np. wodór czy hel). 💧
📘 Wersja szkolna:
Atom dąży do uzyskania konfiguracji elektronowej oktetu elektronowego (czyli 8 elektronów walencyjnych). Taki układ zapewnia stabilność chemiczną.
Wyjątkiem są atomy, których powłoka walencyjna to powłoka „K” – maksymalnie może się na niej znaleźć tylko 2 elektrony (czyli dublet elektronowy).
🔎 Przykłady:
Wodór (H) – ma tylko jedną powłokę, więc do szczęścia potrzebuje 2 elektronów (czyli dublet).
Hel (He) – ma już 2 elektrony, dlatego nie reaguje z innymi atomami – jego powłoka jest „pełna” i stabilna.
🧲 Wiązania chemiczne – czyli jak atomy się trzymają razem
🔬 Dla zrozumienia:
Wyobraź sobie, że atomy to ludzie, którzy chcą trzymać się za ręce – niektóre mocno, inne luźniej. Wiązania chemiczne to sposób, w jaki atomy „dogadują się” i trzymają razem, tworząc związki chemiczne. Wszystko zależy od tego, jak dzielą się elektronami walencyjnymi – czyli tymi, które są na zewnętrznej powłoce.
📘 Wersja szkolna:
Wiązanie chemiczne to trwały sposób połączenia atomów pierwiastków chemicznych, który powstaje w wyniku oddziaływania ich elektronów walencyjnych.
🔗 Rodzaje wiązań chemicznych
🧪 a) Wiązanie jonowe
✅ Powstaje między metalem a niemetalem
✅ Atomy oddają i przyjmują elektrony – jeden staje się jonem dodatnim, drugi ujemnym
✅ Przykład: sól kuchenna (NaCl) – sód (Na) oddaje elektron, chlor (Cl) go przyjmuje
💡 Łatwo zapamiętać:
JONowe = elektrony są oddawane i przyjmowane ➡️ tworzą się JONY
🧪 b) Wiązanie kowalencyjne
To jakby dzielenie się elektronami – nikt nic nie oddaje ani nie zabiera, po prostu atomy wspólnie trzymają elektrony.
Może być:
👉 niespolaryzowane
między atomami tego samego pierwiastka
różnica elektroujemności = 0
elektrony są dzielone po równo
Przykład: cząsteczka tlenu O₂
👉 spolaryzowane
między różnymi pierwiastkami
różnica elektroujemności < 1,7
elektrony są dzielone, ale bardziej przyciąga je jeden z atomów
Przykład: cząsteczka wody H₂O
⚡ Co to jest elektroujemność?
🔍 Dla zrozumienia:
Wyobraź sobie, że dwa atomy ciągną linę – każdy z nich próbuje przyciągnąć do siebie elektrony. Ten, który robi to najmocniej, ma większą elektroujemność. To taka siła przyciągania elektronów 🔗
📘 Wersja szkolna:
Elektroujemność to zdolność atomu pierwiastka chemicznego do przyciągania elektronów tworzących wiązanie chemiczne.
📌 Warto zapamiętać:
Największą elektroujemność ma fluor (niemetal)
Najmniejszą – metale (np. cez, franc)
🔗 Wiązanie kowalencyjne – wspólne elektrony
🧪 Co to jest wiązanie kowalencyjne?
To takie połączenie atomów, w którym dzielą się one elektronami – nie oddają ich, jak w wiązaniu jonowym, tylko trzymają je razem jak wspólny skarb 💎
📘 Wersja szkolna:
Wiązanie kowalencyjne to wiązanie chemiczne, które polega na łączeniu się atomów za pomocą wspólnych par elektronowych.
Tworzy się, gdy różnica elektroujemności atomów jest mniejsza niż 1,7.
🔄 Wiązanie pojedyncze – co to znaczy?
👉 Jeśli atomy dzielą się jedną parą elektronów, mówimy, że powstało wiązanie pojedyncze.
📌 Przykład: Cząsteczka wodoru H₂ – każdy wodór „daje” po jednym elektronie, razem tworzą jedną wspólną parę.
✍️ Co to jest wzór kreskowy strukturalny?
🔍 Dla zrozumienia:
Gdy dwa atomy się „dogadują” i dzielą elektronami, to tę wspólną parę elektronową można zapisać jako kreskę.
Taka kreska = dwa elektrony.
📘 Wersja szkolna:
Wiązanie kowalencyjne utworzone przez wspólną parę elektronową przedstawia się wzorem kreskowym strukturalnym.
➡️ Każda pojedyncza kreska oznacza 2 elektrony, które też można zapisać jako dwie kropki (••).
Łączenie się atomów
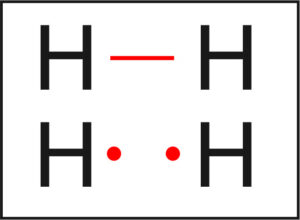
Jak tworzy się cząsteczka wodoru H₂?
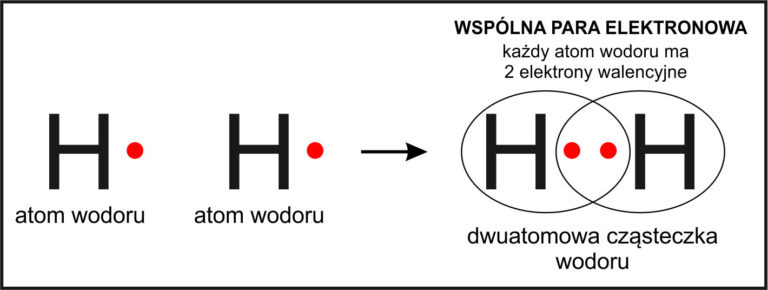
🔸 Wodór ma 1 elektron walencyjny, bo znajduje się w 1. grupie układu okresowego.
🔸 Aby być „szczęśliwy”, potrzebuje jeszcze jednego elektronu – czyli dubletu.
🔸 Dlatego dwa atomy wodoru zbliżają się i tworzą wspólną parę elektronową.
💡 Ta para łączy atomy wodoru i tworzy cząsteczkę H₂, którą można zapisać jako:
H — H lub H••H
📘 Wersja szkolna:
Wodór tworzy wiązanie kowalencyjne, w którym dwa atomy dzielą się wspólną parą elektronową. Powstaje wówczas cząsteczka H₂, a wiązanie zapisuje się jako pojedyncza kreska łącząca atomy.
🧪 Jak łączą się atomy chloru?

🔍 Zrozum to łatwo:
Chlor chce mieć pełną powłokę walencyjną – czyli 8 elektronów (to się nazywa oktet elektronowy 🟢).
A ponieważ ma 7 elektronów walencyjnych, brakuje mu jednego.
Dlatego jeden atom chloru może połączyć się z drugim atomem chloru, który też ma 7 elektronów walencyjnych.
Oba dzielą się jednym elektronem, żeby każdy z nich miał „pełną ósemkę”.
📘 Wersja szkolna:
Chlor znajduje się w 17. grupie układu okresowego, więc ma 7 elektronów walencyjnych. Aby uzyskać oktet elektronowy, potrzebuje 1 elektronu.
Dlatego dwa atomy chloru łączą się wiązaniem kowalencyjnym poprzez jedną wspólną parę elektronową. Powstaje cząsteczka Cl₂.
🧩 Wzór kreskowy strukturalny:
Cl — Cl lub Cl••Cl
Co dalej?
Należy napisać wzór elektronowy i ustalić liczbę wspólnych par elektronowych.
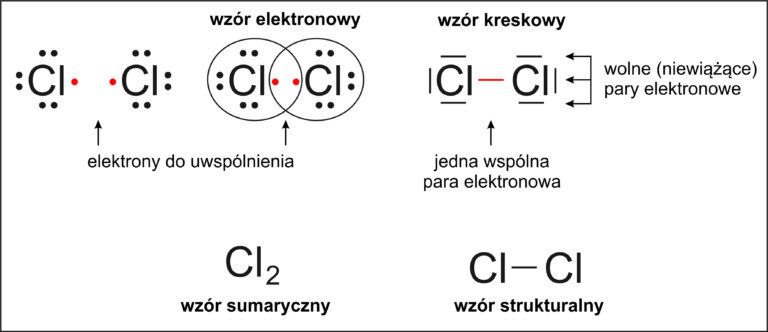
🔸 Każdy z atomów chloru ma oktet elektronowy:
→ 2 elektrony ze wspólnej pary elektronowej
→ 6 elektronów tworzących 3 wolne pary elektronowe
✅ Razem to 8 elektronów.
🔸 Wiązanie oznaczone jest kreską
(czyli tworzą je 2 elektrony),
czyli jest to 1 wspólna para elektronowa.
📌 Powstaje więc wiązanie pojedyncze.
📘 Rodzaje wiązań:
Wiązanie pojedyncze – tworzą 2 elektrony walencyjne
Wiązanie potrójne – tworzy 6 elektronów walencyjnych
🌡️ Jak łączą się atomy dwóch różnych niemetali?
🔸 Atomy dwóch różnych niemetali również łączą się za pomocą wiązań kowalencyjnych.
📘 Przykład:
→ Wodór (H) + Tlen (O) → cząsteczka wody (H₂O)
Wodór dostarcza 1 elektron, tlen – 2 elektrony walencyjne potrzebne do utworzenia dwóch wiązań pojedynczych.
🧪 Jak powstaje wiązanie kowalencyjne w cząsteczce chlorowodoru (HCl)?
Aby zrozumieć, jak powstaje cząsteczka chlorowodoru, musimy sprawdzić, ile elektronów walencyjnych mają atomy wodoru i chloru:
🔹 Wodór
– znajduje się w 1. grupie układu okresowego
– ma 1 elektron walencyjny
– aby osiągnąć trwały stan (czyli dublet elektronowy), potrzebuje 1 elektronu
🔹 Chlor
– znajduje się w 17. grupie układu okresowego
– ma 7 elektronów walencyjnych
– aby osiągnąć trwały stan (czyli oktet elektronowy), potrzebuje 1 elektronu
🧲 Co się dzieje dalej?
Atom wodoru i chloru uwspólniają po jednym elektronie, dzięki czemu:
wodór uzyskuje dublet elektronowy
chlor uzyskuje oktet elektronowy
🔗 W ten sposób między atomami tworzy się jedno wiązanie kowalencyjne pojedyncze – przedstawiane jako kreska w zapisie kreskowym (H–Cl).
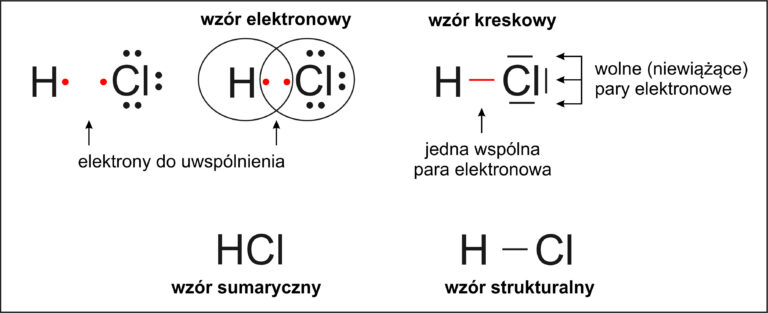
W cząsteczce HCl (chlorowodór) powstaje 1 wiązanie pojedyncze.
💨Jak powstaje wiązanie kowalencyjne w cząsteczce
tlenku węgla (IV) – CO₂?
Aby zrozumieć, jak powstaje cząsteczka CO₂ (tlenek węgla IV), sprawdźmy liczbę elektronów walencyjnych każdego z pierwiastków:
🔹 Tlen (O)
– znajduje się w 16. grupie układu okresowego
– ma 6 elektronów walencyjnych
– do uzyskania oktetu elektronowego brakuje mu 2 elektronów
🔹 Węgiel (C)
– znajduje się w 14. grupie układu okresowego
– ma 4 elektrony walencyjne
– do uzyskania oktetu elektronowego brakuje mu 4 elektronów
🧲 Co się dzieje dalej?
Aby każdy z atomów uzyskał trwały układ elektronów:
węgiel łączy się z dwoma atomami tlenu,
z każdym z nich tworzy podwójne wiązanie (czyli 2 wspólne pary elektronowe).
Dzięki temu:
węgiel dzieli się łącznie 4 elektronami, po 2 z każdym tlenem,
każdy tlen dzieli się 2 elektronami z węglem, a pozostałe elektrony pozostają jako wolne pary.
🔗 W zapisie kreskowym wygląda to tak:
O=C=O
✅ W cząsteczce CO₂ występują więc dwa wiązania kowalencyjne podwójne.
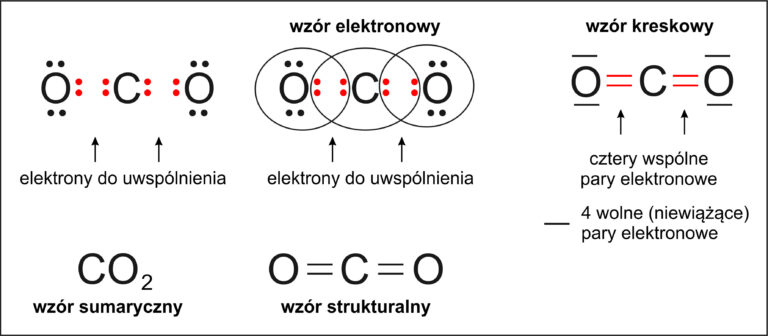
Wiązanie kowalencyjne utworzone za pomocą 2 wspólnych par elektronowych nazywa się wiązaniem podwójnym.
W cząsteczce tlenku węgla (IV) powstają 2 wiązania podwójne.
⚛️ Jak określić rodzaj wiązania na podstawie elektroujemności?
🔬 Elektroujemność to zdolność atomu do przyciągania elektronów. Dzięki niej możemy określić, jaki rodzaj wiązania chemicznego powstanie między atomami.
🟢 1. Wiązanie kowalencyjne niespolaryzowane
✅ Kiedy?
Gdy łączą się atomy tego samego pierwiastka, np.:
O₂ (tlen),
F₂ (fluor).
🧠 Dlaczego?
Bo mają taką samą elektroujemność, więc równomiernie „dzielą się” elektronami.
🟠 2. Wiązanie kowalencyjne spolaryzowane
✅ Kiedy?
Gdy łączą się różne pierwiastki, np.:
HCl (chlorowodór),
CO₂ (tlenek węgla IV).
🧠 Dlaczego?
Bo elektrony przesuwają się w stronę pierwiastka o większej elektroujemności.
🔋 Co się dzieje?
Powstają dwa bieguny:
– biegun ujemny (tam, gdzie elektrony się przesunęły)
– biegun dodatni (tam, gdzie elektronów ubyło)
🌈 Taka cząsteczka staje się spolaryzowana, czyli ma „polaryzację” elektronów – i stąd nazwa: wiązanie kowalencyjne spolaryzowane.
Łączenie się atomów
Przykładowe zestawienia zadań
Przykładowe zestawienia zadań, które mogą być idealnym treningiem przed realnym sprawdzianem.
Pliki do pobrania w .pdf i wydrukowania TUTAJ
