Kwasy – poznaj substancje, które zmieniają kolor i nie tylko!
Kwasy to grupa związków chemicznych, które mają bardzo ciekawe właściwości – potrafią zmieniać kolor wskaźników, reagują z metalami, a niektóre z nich… znajdziesz w swojej kuchni! W tym dziale chemii klasa 8 dowiesz się, czym są kwasy, jak wygląda ich budowa, jakie mają właściwości fizyczne i chemiczne, a także nauczysz się zapisywać wzory i reakcje z ich udziałem. Sprawdzimy, do czego wykorzystuje się kwasy w życiu codziennym i jak je rozpoznać – nie tylko w laboratorium!
Kwasy
🧪 Podstawowe pojęcia – Kwasy
🔹 KWAS
👉 W prostych słowach: To taka cząsteczka, która zawiera atomy wodoru – i właśnie ten wodór „odczuwamy” w reakcjach chemicznych (np. gdy kwas działa na metal albo zmienia kolor wskaźnika).
📘 Definicja szkolna: Kwasy to związki chemiczne, których cząsteczki zbudowane są z atomów wodoru i reszty kwasowej.
🔹 RESZTA KWASOWA
👉 W prostych słowach: To ten drugi składnik kwasu – wszystko poza wodorem. Każdy kwas ma „resztę kwasową”, która decyduje o jego rodzaju.
📘 Definicja szkolna: Reszta kwasowa to atom lub grupa atomów znajdujące się w cząsteczce każdego kwasu obok atomu wodoru.
🔹 KWAS BEZTLENOWY
👉 W prostych słowach: To kwas, który nie zawiera tlenu – czyli ma tylko wodór i resztę kwasową bez tlenu. Przykład: HCl (kwas solny).
📘 Definicja szkolna: Kwas beztlenowy to kwas, którego cząsteczka nie zawiera atomów tlenu.
🔹 KWAS TLENOWY
👉 W prostych słowach: To taki kwas, który oprócz wodoru i reszty kwasowej zawiera także tlen. Przykład: H₂SO₄ (kwas siarkowy(VI)).
📘 Definicja szkolna: Kwas tlenowy to kwas, którego cząsteczka zawiera atomy tlenu.
JAK SĄ ZBUDOWANE KWASY?
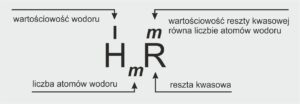
👉 W prostych słowach:
Wyobraź sobie, że kwas to drużyna składająca się z wodoru i reszty kwasowej.
Wodór to taki zawodnik, który jako pierwszy wchodzi do akcji – często to on bierze udział w reakcjach chemicznych.
Reszta kwasowa to druga część drużyny – może zawierać tlen (lub nie), ale zawsze decyduje o tym, jaki to rodzaj kwasu.
💡 Przykłady:
HCl (kwas solny) → ma wodór (H) i resztę kwasową Cl (chlor) → kwas beztlenowy
H₂SO₄ (kwas siarkowy(VI)) → ma wodór (H), resztę kwasową SO₄ i tlen → kwas tlenowy
📘 Definicja szkolna:
Każdy kwas zbudowany jest z atomów wodoru i reszty kwasowej.
Jeśli cząsteczka nie zawiera atomów tlenu – mówimy o kwasie beztlenowym (np. HCl).
Jeśli cząsteczka zawiera atomy tlenu – mamy kwas tlenowy (np. H₂CO₃, HNO₃).
📚 Podział kwasów nieorganicznych
Kwasy nieorganiczne dzielimy na:
Kwasy beztlenowe – ich cząsteczki nie zawierają atomów tlenu. Resztę kwasową tworzą tylko atomy niemetalu.
Kwasy tlenowe – ich cząsteczki zawierają atomy tlenu. Resztę kwasową tworzy grupa złożona z niemetalu i tlenu.
📌 Podział kwasów nieorganicznych
| KWASY BEZTLENOWE | KWASY TLENOWE |
|---|---|
| Resztę kwasową HmR tworzą atomy niemetali (np. HCl – kwas solny) | Resztę kwasową HmR tworzy grupa zawierająca atomy niemetalu i atomy tlenu (np. H2SO4 – kwas siarkowy(VI)) |
🧪 Jak tworzy się nazwy i wzory kwasów beztlenowych?
Nazwy kwasów beztlenowych tworzymy według schematu:
🔹 kwas + nazwa niemetalu + końcówka –wodorowy
(nazwa niemetalu pochodzi od reszty kwasowej)
Wzory takich kwasów zawierają tylko atomy wodoru i niemetalu – bez tlenu.
📌 Przykłady kwasów beztlenowych
| Wzór chemiczny | Nazwa kwasu | Skład |
|---|---|---|
| HCl | kwas chlorowodorowy | atom wodoru + atom chloru |
| H2S | kwas siarkowodorowy | 2 atomy wodoru + atom siarki |
🧪 Jak tworzy się nazwy i wzory kwasów tlenowych?
Kwas tlenowy to taki, którego cząsteczka zawiera wodór, niemetal i tlen.
Jak tworzymy nazwę?
Do słowa kwas dodajemy nazwę niemetalu, który występuje w reszcie kwasowej, oraz końcówkę –owy.
Gdy niemetal może tworzyć kilka różnych kwasów (o różnych wartościach), w nawiasie podajemy jego wartościowość zapisaną cyfrą rzymską.
Przykłady kwasów tlenowych
| Wzór chemiczny | Nazwa kwasu | Zawarte pierwiastki |
|---|---|---|
| H2CO3 | kwas węglowy | wodór + węgiel + tlen |
| kwas siarkowy(IV) | wodór + siarka (IV) + tlen | |
| kwas siarkowy(VI) | wodór + siarka (VI) + tlen |
Tabela Kwasów Tlenowych
| Rodzaj kwasu | Wzór sumaryczny | Nazwa kwasu |
|---|---|---|
| kwas tlenowy | 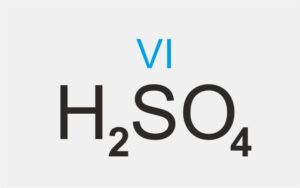 H2SO4 H2SO4 | kwas siarkowy(VI) |
| kwas tlenowy | kwas siarkowy(IV) | |
| kwas tlenowy |  HNO3 HNO3 | kwas azotowy(V) |
| kwas tlenowy | 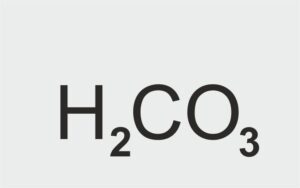 H2CO3 H2CO3 | kwas węglowy |
| kwas tlenowy | 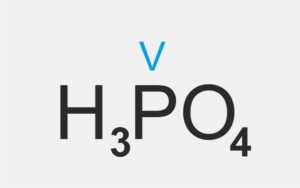 H3PO4 H3PO4 | kwas fosforowy(V) |
🧪 Na czym polega dysocjacja jonowa kwasów?
Wyobraź sobie, że cząsteczka kwasu to drużyna trzymająca się za ręce. Gdy wrzucisz ją do wody, rozdziela się na dwa składniki: 💥
kationy wodoru (czyli dodatnie jony H⁺),
aniony reszty kwasowej (czyli ujemne resztki cząsteczki).
👉 Takie rozdzielenie na jony nazywamy dysocjacją jonową.
📌 Jeśli kwas ma więcej niż jeden atom wodoru, to nie rozdziela się od razu cały – dysocjuje stopniowo, czyli po kolei oddaje swoje jony wodoru.
📘 Definicja szkolna:
Dysocjacja jonowa kwasów – to proces rozpadu cząsteczek kwasów w roztworach wodnych na kationy wodoru (H⁺) i aniony reszty kwasowej.
➡️ Kwas zawierający więcej niż jeden atom wodoru ulega dysocjacji stopniowej, tzn. jony H⁺ odłączają się po kolei w kolejnych etapach.
💧 Czy woda ulega dysocjacji jonowej? – wyjaśnienie prostym językiem
Tak, woda też może się rozdzielić na jony, ale robi to bardzo, bardzo rzadko. To tak, jakby tylko jedna kropelka w ogromnym oceanie rozdzieliła się na dwie części.
Z cząsteczki wody powstają wtedy:
jon wodorowy (H⁺) – dodatni,
jon wodorotlenkowy (OH⁻) – ujemny.
📘 Wersja szkolna
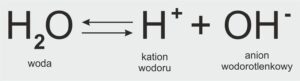
Woda w bardzo niewielkim stopniu ulega dysocjacji jonowej według równania:
H₂O ⇌ H⁺ + OH⁻
➡️ Oznacza to, że woda jako czysta substancja może się rozkładać na jony H⁺ i OH⁻, ale zjawisko to zachodzi w bardzo małym zakresie – zaledwie jedna cząsteczka na około 10 milionów.
🔬 Jakie właściwości mają kwasy?
🧠 Dla ucznia – czyli po ludzku:
Kwasy to takie związki, które:
💡 przewodzą prąd, kiedy są rozpuszczone w wodzie – czyli działają jak „przewodnik prądu”;
💧 w wodzie rozpadają się na cząstki – dodatnie i ujemne (czyli jony);
🌈 zmieniają kolor wskaźników, np. lakmus staje się czerwony – i to niezależnie od rodzaju kwasu!
📘 Wersja szkolna (definicje):
Kwasy są elektrolitami, czyli ich wodne roztwory przewodzą prąd elektryczny ⚡.
W roztworach wodnych kwasy ulegają dysocjacji jonowej – rozpadają się na kationy wodoru (H⁺) i aniony reszt kwasowych.
Kwasy barwią wskaźniki w sposób charakterystyczny – np. lakmus na czerwono.
Zachowanie wskaźników w roztworach kwasów
| Wskaźnik | Barwa w roztworze kwasu |
|---|---|
| Lakmus | Czerwona |
| Fenoloftaleina | Bezbarwna |
| Uniwersalny papierek wskaźnikowy | Czerwona lub pomarańczowa |
🔬 Jak wykryć obecność kwasów w roztworze?
👧 Dla ucznia:
Chcesz sprawdzić, czy jakiś płyn to kwas? Użyj wskaźników! To takie specjalne substancje, które zmieniają kolor w obecności kwasu.
🧪 Przykłady wskaźników:
Oranż metylowy – zmienia kolor z pomarańczowego na czerwony, gdy w roztworze jest kwas.
Uniwersalny papierek wskaźnikowy – przyjmuje barwę od pomarańczowej do czerwonej w obecności kwasu.
📘 Wersja szkolna (definicja):
Obecność kwasów w roztworach wodnych wykrywa się za pomocą wskaźników, które zmieniają barwę – np. oranż metylowy i papierek wskaźnikowy.
🧪 Czym jest odczyn roztworu?
👧 Dla ucznia:
Odczyn roztworu mówi nam, czy roztwór jest kwaśny, obojętny czy zasadowy. Zależy to od tego, jakie jony przeważają w roztworze:
➕ Gdy jest więcej jonów wodoru H⁺, roztwór ma odczyn kwasowy.
⚖️ Gdy ilość jonów H⁺ i OH⁻ jest taka sama, roztwór ma odczyn obojętny.
➖ Gdy przeważają jony wodorotlenkowe OH⁻, roztwór ma odczyn zasadowy.
📘 Definicja szkolna:
Odczyn roztworu to cecha roztworu określająca, czy zawiera on nadmiar jonów H⁺ (kwasowy), OH⁻ (zasadowy), czy też ich ilości są równe (obojętny). Określa się go za pomocą wskaźników pH.
🔬 Co to jest pH roztworu?
👧 Dla ucznia:
pH to liczba, która mówi nam, czy roztwór jest kwaśny, obojętny czy zasadowy. Wszystko zależy od ilości jonów H⁺ (jonów wodoru) w wodzie.
📘 Definicja szkolna:
pH roztworu to miara kwasowości roztworu, zależna od stężenia jonów wodoru (H⁺) obecnych w tym roztworze.
📏 Czym jest skala pH?
Skala pH ma wartości od 0 do 14. Dzięki niej można łatwo określić odczyn roztworu:
| Zakres pH | Odczyn roztworu | Co się dzieje w roztworze? |
|---|---|---|
| pH = 7 | ⚖️ obojętny | Równe stężenie H⁺ i OH⁻ |
| pH < 7 | 🍋 kwasowy | 🔺 więcej H⁺, 🔻 mniej OH⁻ |
| pH > 7 | 🧼 zasadowy | 🔻 mniej H⁺, 🔺 więcej OH⁻ |
🔍 Kwasy – Ciekawostka
📽️ Zobacz film edukacyjny o kwasach
Kwasy
Przykładowe zestawienia zadań
Przykładowe zestawienia zadań, które mogą być idealnym treningiem przed realnym sprawdzianem.
Pliki do pobrania w .pdf i wydrukowania TUTAJ
